
1564
Anestesia por subespecialidades en el adulto
IV
contienen transmisores excitatorios como glutamato, sustancia P y
factores neurotróficos que activan los receptores postsinápticos de
N
-metil-d-aspartato (NMDA), neurocinina y tirosina cinasa, res-
pectivamente. La estimulación repetida de los nociceptores puede
sensibilizar tanto las neuronas centrales como las periféricas (plas-
ticidad dependiente de la actividad). En las neuronas espinales este
aumento progresivo en el flujo de salida en respuesta a la excitación
persistente del nociceptor se ha denominado
«wind-up»
(sobreex-
citación). Posteriormente, la sensibilización puede mantenerse
mediante cambios de transcripción en la expresión de la codifica-
ción genética de diversos neuropéptidos, transmisores, canales
iónicos, receptores y moléculas de señalización (plasticidad depen-
diente de la transcripción) tanto en nociceptores como en neuronas
espinales. Ejemplos importantes son el receptor NMDA, la ciclooxi-
genasa 2 (COX-2), los canales de Ca
2+
y Na
+
y las citocinas y qui-
miocinas expresadas por neuronas y células de la glí
a 7,8 .Además,
aparece una redistribución física de los circuitos neuronales
mediante la apoptosis, el crecimiento nervioso y la ramificación
(sprouting)
en el sistema nervioso central y el periféric
o 1,5 .Por
razones éticas, los estudios en animales son limitados hasta algunos
días o semanas, pero el dolor crónico en humanos persiste durante
meses o años. Por tanto, los modelos animales no son espejos de la
verdadera situación clínica y son denominados de forma precavida
«dolor persistente». Los estudios de imagen cerebral han comen-
zado a investigar cambios en pacientes con dolor neuropático, dolor
de miembro fantasma, neuralgia postherpética, lumbalgia y otros
síndromes de dolor crónico. Sin embargo, con la excepción de las
cefaleas primarias, los estudios funcionales con imagen todavía no
han proporcionado hallazgos reproducibles específicos para la
enfermedad o bases fisiopatológicas para estos síndrome
s 9.
Mecanismos inhibitorios
De forma concurrente con los episodios descritos previamente, pode-
rosos mecanismos endógenos contrarrestan el dolor desplegándose
tanto en el sistema nervioso central como en el periférico. En los
tejidos lesionados esto sucede mediante interacciones entre pépti
dos opioides derivados de leucocitos y terminales nociceptivos peri-
féricosqueexpresanreceptoresopioide
s 10,11,yporlaaccióndecitocinas
antiinflamatoria
s 2 .La inflamación del tejido periférico provoca un
aumento de la expresión, del transporte axonal y del acoplamiento de
proteínas G de los receptores opioides en las neuronas en el ganglio
de la raíz dorsal. Estos fenómenos son dependientes de la actividad
eléctrica de neuronas sensitivas, de la producción de citocinas proin-
flamatorias y de la presencia de factores de crecimiento nervioso
dentro del tejido inflamad
o 12 .De forma paralela, las células inmunes
que contienen péptidos opioides se extravasan y se acumulan en el
tejido inflamad
o 13,14 .Estas células aumentan la expresión genética de
los precursores de los péptidos opioide
s 15y de la maquinaria enzimá-
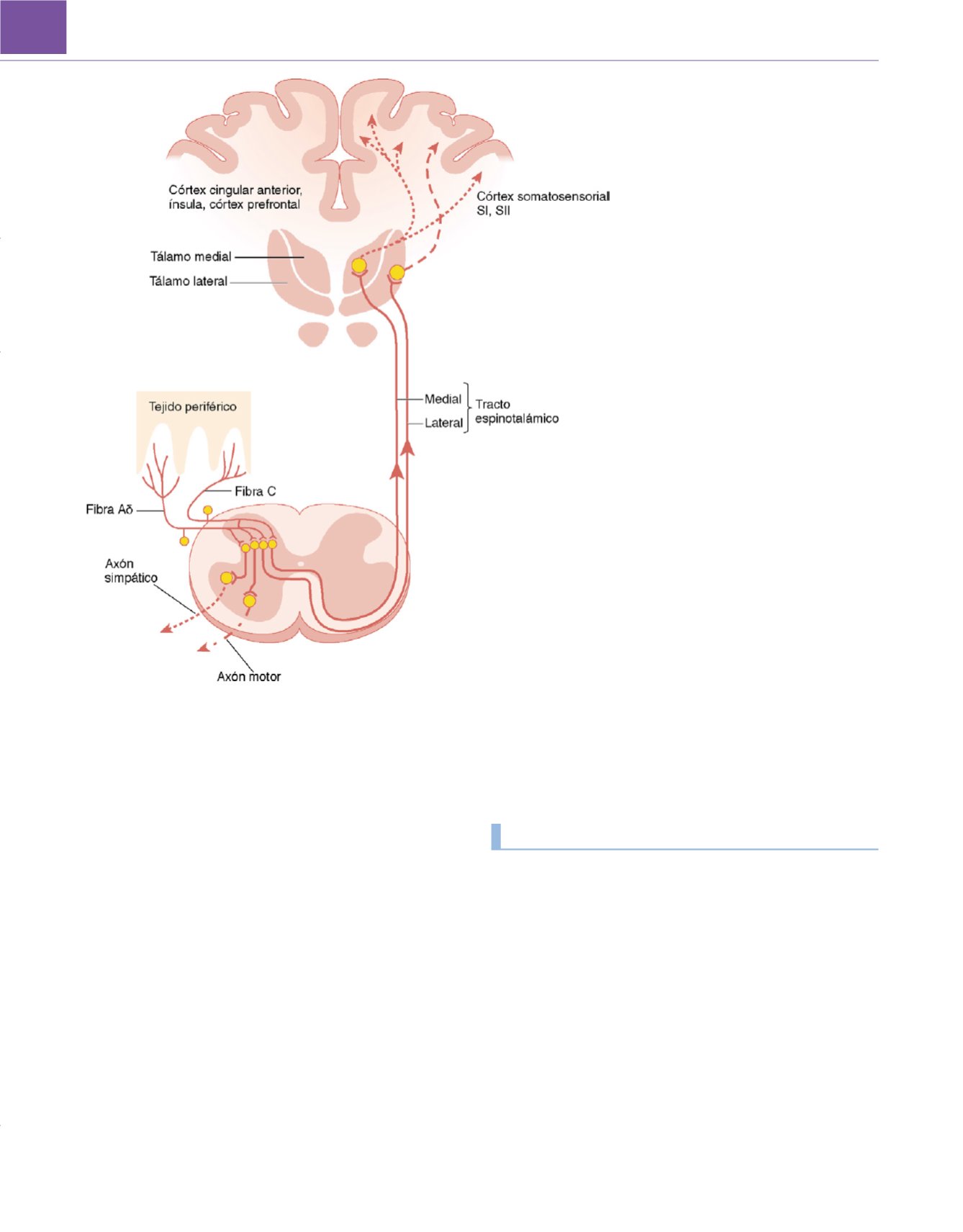
Figura 48-1
Vías nociceptivas. Para más detalles véase
el texto. (
Adaptada de Brack A, Stein C, Schaible HG:
Periphere und zentrale Mechanismen des
Entzüngsschmerzes.
En
Straub RH [ed]:
Lehrbuch der
klinischen Pathophysiologie komplexer chronischer
Erkrankungen,
vol. 1. Göttingen, Alemania, Vandenhoeck
& Ruprecht, 2006, págs. 183-192
).









