
Anestesia y tratamiento del dolor crónico
1565
48
Sección IV
Anestesia por subespecialidades en el adulto
© ELSEVIER. Fotocopiar sin autorización es un delito
tica para su procesamiento en péptidos funcionalmente activo
s 16 .Como respuesta al estrés, al factor de liberación de corticotropinas, a
las citocinas, a las quimiocinas o a las catecolaminas, los leucocitos
secretan opioides, los cuales activan los receptores periféricos opioi-
des y producen analgesia inhibiendo la excitabilidad de los noci
ceptores o la liberación de neuropéptidos excitatorios, o ambas
( fig.48-2 ) 17,18 .Larelevanciaclínicadeestosmecanismossehademostra
do en estudios que muestran que pacientes con inflamación de la
articulación de la rodilla expresan péptidos opioides en células
inmunes y receptores opioides en terminales nerviosos sensitivos
dentro del tejido sinovial. Después de la cirugía de rodilla, estos
pacientes mostraban un significativo aumento del dolor postoperato-
rio y del consumo de analgésicos cuando la interacción entre los
péptidos opioides y los receptores se bloqueaba por la aplicación
intraarticular del antagonista naloxon
a 19,20.
En la médula espinal, la inhibición está mediada por la libe-
ración de opioides, ácido gamma-aminobutírico (GABA) o glicina
de las interneuronas, las cuales activan los receptores presinápticos
opioides o GABA (o ambos) en las terminaciones nociceptivas
centrales para disminuir la liberación de aminoácidos excitatorios.
Además, la apertura de canales postsinápticos de K
+
o Cl
–
por opioi-
des o GABA, respectivamente, provoca potenciales de hiperpolari-
zación inhibitorios en las neuronas del asta dorsal. Mientras existe
estimulación de los nociceptores, las interneuronas espinales
aumentan la regulación de la expresión genética y la producción
de péptidos opioide
s 21,22. Las poderosas vías inhibitorias descen-
dentes del tronco cerebral también se vuelven activas operando
fundamentalmente a través de los sistemas noradrenérgicos, sero-
toninérgicos y opioides. Una región clave es la sustancia gris
periacueductal. Se proyecta hasta la médula ventromedial rostral,
y a continuación a lo largo del funículo dorsolateral hasta el asta
dorsal. La integración de las señales de los neurotransmisores inhi-
bitorios y excitatorios con los factores cognitivos, emocionales y
ambientales (v. más adelante) da lugar finalmente a la percepción
central del dolor. Cuando el intrincado equilibrio entre los factores
biológicos, psicológicos y sociales se altera puede desarrollarse
dolor crónico.
Definiciones clínicas, prevalencia
y clasificación del dolor crónico
Definiciones
La Sociedad Internacional para el Estudio del Dolor (IASP) define el
dolor como «una experiencia sensorial y emocional desagradable
asociada con daño tisular actual o potencial, o descrita en términos
de tal daño
» 24. Esta clasificación posteriormente establece que el dolor
es siempre subjetivo y que es una sensación de una parte del cuerpo.
Al mismo tiempo, es desagradable y, por tanto, tiene un componente
emocional. Muchas personas manifiestan dolor en ausencia de lesión
tisular u otra probable causa fisiopatológica. Habitualmente no existe
una forma de distinguir su experiencia de aquélla atribuible a lesión
tisular. Si los pacientes valoran su experiencia como dolor o la mani-
fiestan de la misma forma que como el dolor provocado por daño
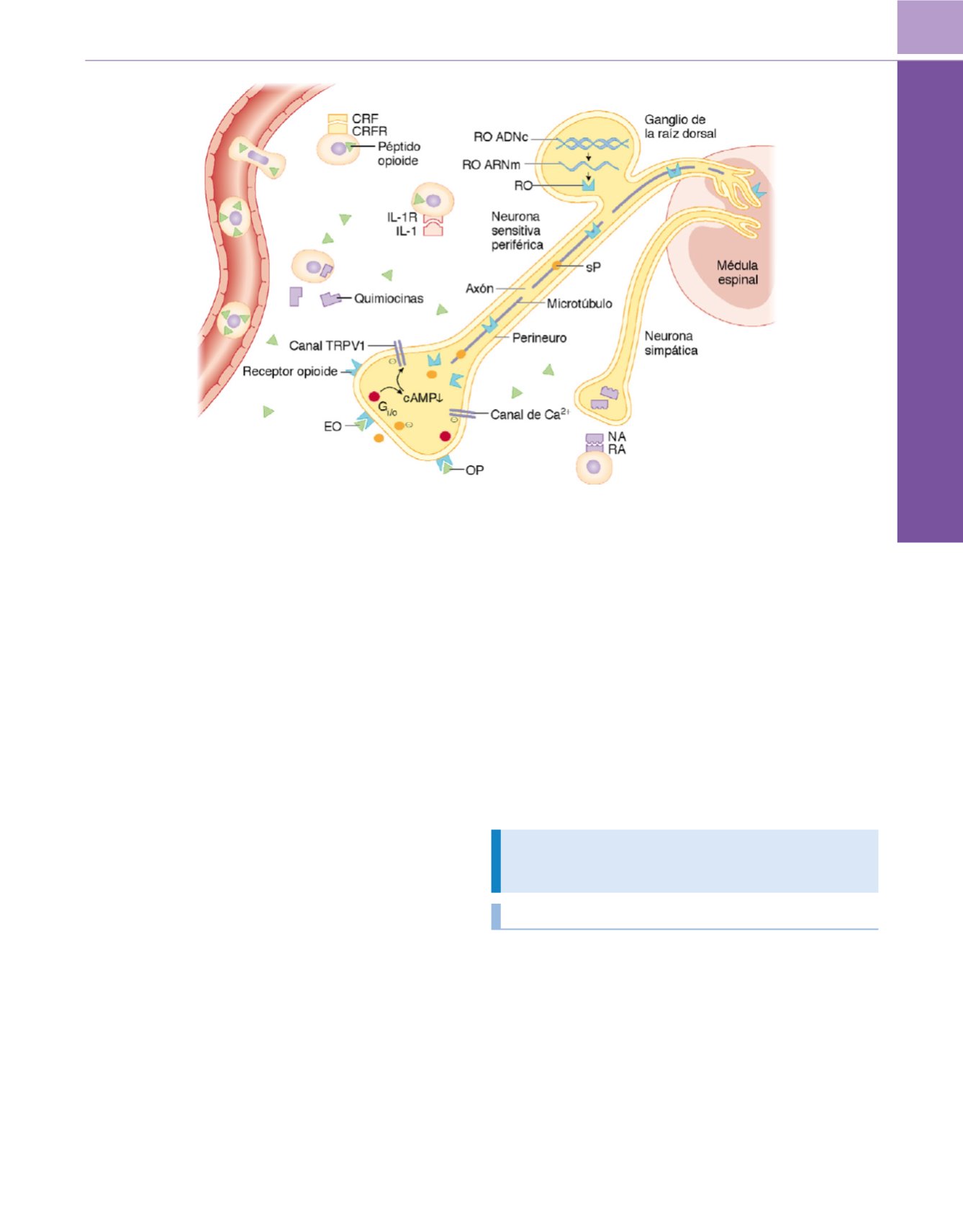
Figura 48-2
Mecanismos endógenos antinociceptivos en el tejido periférico lesionado. Los leucocitos circulantes que expresan péptido opioide se extravasan
por la activación de moléculas de adhesión y quimiotaxis por quimiocinas. Posteriormente, estos leucocitos son estimulados por el estrés o por agentes
circulantes para secretar péptidos opioides. Por ejemplo, el factor de liberación de corticotropina (CRF), la interleucina-1
b
(IL-1) y la noradrenalina (NA, liberada
desde neuronas simpáticas) pueden generar la liberación de opioides mediante la activación de sus respectivos receptores CRF (CRFR), los receptores de IL-1
(IL-1R) y los receptores adrenérgicos (RA) en los leucocitos. Los opioides exógenos (EO) o los péptidos opioides endógenos (OP)
(triángulos verdes)
se unen a
los receptores opioides (RO), que son sintetizados en el ganglio de la raíz dorsal y transportados a lo largo de los microtúbulos intraaxonales hasta los
terminales de las neuronas sensitivas periféricas (y centrales). La consiguiente inhibición de los canales iónicos (p. ej., TRPV 1, Ca
2+
) (v. fig. 48-3 y el texto) y la
liberación de sustancia P (sP) produce efectos antinociceptivos. AMPc, adenosín monofosfato cíclico. (
Adaptada de Rittner HL, Machelska H, Stein C:
Leukocytes in the regulation of pain and analgesia
. J Leukoc Biol
78:1215-1222, 2005.
)









