
680
Farmacología y anestesia
II
especializado del corazón. Los anestésicos locales pueden suprimir
la sensación en diversas zonas del cuerpo tras su aplicación tópica,
tras la inyección en la proximidad de las terminaciones nerviosas
periféricas o de los troncos nerviosos de mayor calibre, o tras su
instilación en el interior del espacio subaracnoideo o epidural. La
toxicidad puede ser local o sistémica. En la clínica, los sistemas
afectados con mayor frecuencia por reacciones de toxicidad aguda
son el sistema nervioso central y el sistema cardiovascular.
Farmacología básica
Química
La molécula del anestésico local
La molécula típica de un anestésico local, como la lidocaína o la
procaína
( fig. 20-1), contiene una amina terciaria unida por medio
de una cadena intermedia a un anillo aromático sustituido. La
cadena casi siempre contiene una unión éster
o
amida
. De este modo, los anestésicos locales pueden
clasificarse en dos grupos, según sean aminoésteres o aminoami-
das. El anillo aromático proporciona un carácter lipofílico (afín a
la membrana) a la porción de la molécula en la que se encuentre,
mientras que el extremo de la amina terciaria es relativamente
hidrofílico, en particular porque se encuentra parcialmente proto-
nada y por tanto posee una carga positiva en el rango del pH
fisiológico
( fig. 20-2). Las estructuras de los anestésicos locales más
comúnmente empleados, así como sus propiedades fisicoquímicas,
se muestran en las tablas
20-1y
20-2, respectivamente.
Relaciones estructura-actividad
y propiedades fisicoquímicas
La potencia intrínseca y la duración de acción de los anestésicos
locales dependen claramente de ciertas características moleculares.
Equilibrio hidrofílico-lipofílico
El carácter hidrófilo o lipófilo de los anestésicos locales depende del
tamaño de los sustitutos alquilos próximos a la amina terciaria o al
anillo aromático. La «lipofilia» expresa la tendencia de un compuesto
a asociarse con las membranas lipídicas, lo que suele indicarse por el
reparto equilibrado en un solvente hidrofóbico como el octano
l 1.
Dichos coeficientes de reparto tampón/octanol son comparables a los
coeficientes de reparto tampón/membrana de los anestésicos locales
no cargados, pero infravaloran enormemente el reparto en la mem-
brana de las especies protonadas cargadas, por lo que el octanol es un
mal modelo para las regiones polares de la superficie de la membrana,
donde se concentran los anestésicos locale
s 2 .En este capítulo, el
término
hidrofobia,
expresado mediante el cociente tampón/octanol,
describe una propiedad fisicoquímica de los anestésicos locales.
Los compuestos con unas propiedades más hidrófobas se
obtienen aumentando el tamaño de los residuos alquilos. Estos
agentes son más potentes que los compuestos menos hidrófobos y
producen bloqueos de mayor duració
n 3-5 .Por ejemplo, la etidocaína,
que posee tres átomos de carbonomás que la lidocaína en el extremo
amina de la molécula, es cuatro veces más potente y cinco veces más
duradera en cuanto al bloqueo de la transmisión de los potenciales
de acción en una preparación de nervio ciático aislado.
Concentración del ion hidrógeno
Los anestésicos locales en solución mantienen un equilibrio
químico rápido entre la forma básica no cargada (B) y la forma
catiónica cargada (BH
+
). A una cierta concentración de ion hidró-
geno (log
10
−1
[–pH]), específica para cada fármaco, la concentra-
ción de anestésico local en su forma básica en una solución es igual
a la concentración de catión cargado. El logaritmo de esta concen-
tración de ion hidrógeno se denomina p
K
a
. La relación se define
mediante la siguiente fórmula:
(1)
En la
tabla 20-2se enumeran los valores de la p
K
a
de los anes-
tésicos locales en solución acuosa. La tendencia a encontrarse en la
Figura 20-1
Estructuras de dos anestésicos locales, la lidocaína (una
aminoamida) y la procaína (un aminoéster). En ambas moléculas se une un
grupo aromático hidrofóbico a una base más hidrofílica, la amina terciaria,
por medio de un grupo éster o amida.
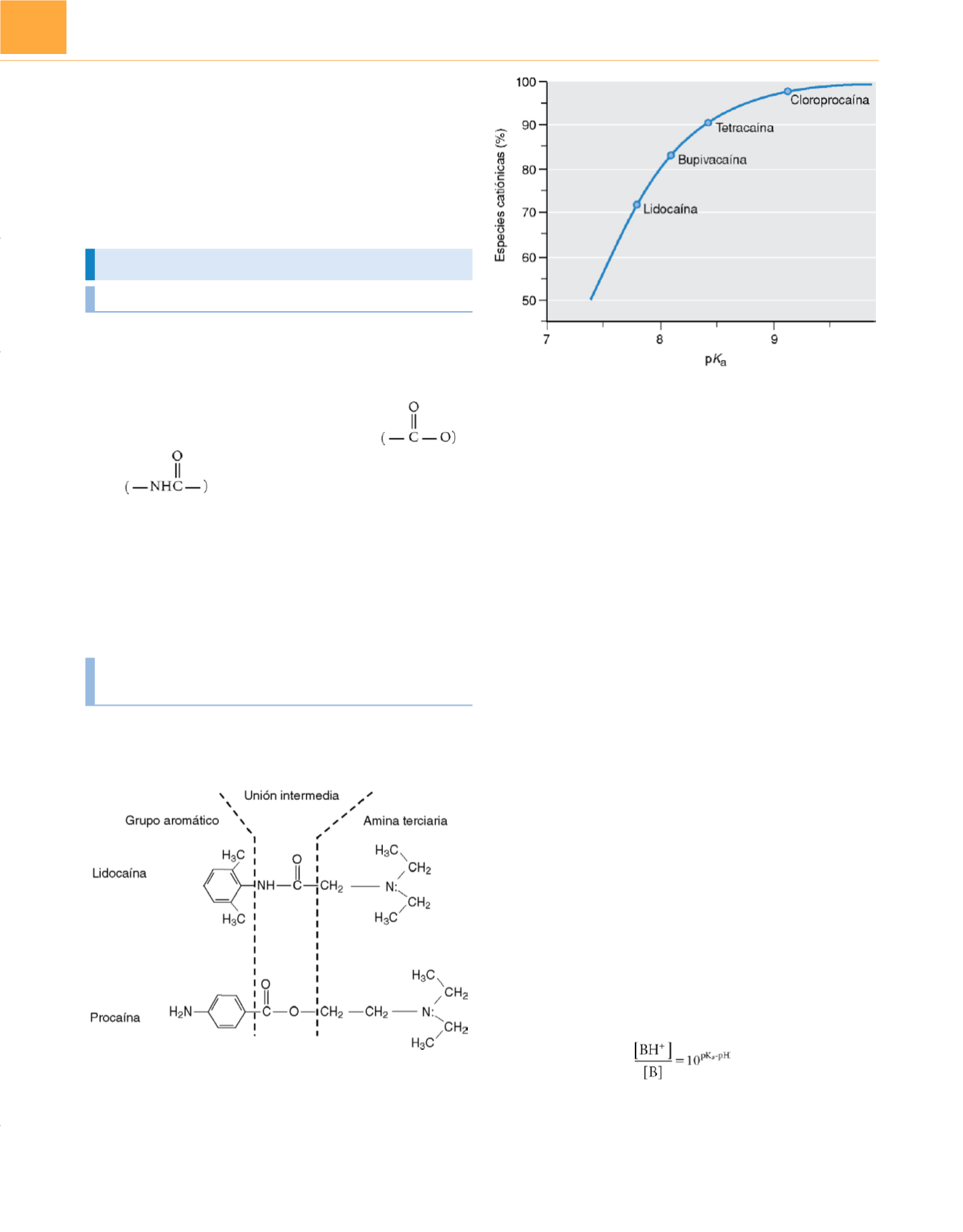
Figura 20-2
Fracción de anestésico local en la forma protonada catiónica en
una solución acuosa a pH fisiológico (7,4), en función de la p
K
a
del fármaco.
El fármaco con la menor p
K
a
, la lidocaína, posee la menor cantidad de
moléculas protonadas y la mayor cantidad de moléculas en su forma neutra.
Sucede lo contrario en el caso de la cloroprocaína, el anestésico con la mayor
p
K
a
. En una solución, las moléculas individuales de los fármacos se protonan
y desprotonan en milésimas de segundo.









