
congruente con las nociones pasivas del sueño en las que se disipan
las aferencias promotoras de la vigilia. Durante el sueño NREM los
grupos monoaminérgicos, orexinérgicos y colinérgicos son inhibi-
dos por señales eferentes que proceden del hipotálamo preóptico
anterior, en concreto un grupo de neuronas localizadas en el núcleo
POVL que utilizan los neurotransmisores inhibidores GABA y gala-
nina (v.
fig. 1-4 ). Las neuronas del POVL están activas durante el
sueño y tienen mayores frecuencias de descarga y expresión génica
temprana inmediata de c-Fos durante el sueñ
o 13,23 .Las neuronas del
POVL activas durante el sueño tienen una relación antagonista con
los centros activos durante la vigilia, de modo que la activación del
POVL inhibe la descarga de los centros activos durante la vigilia.
Por el contrario, la descarga rápida de las regiones activas durante
la vigilia inhibe al núcleo POVL. Este diseño de red lleva a un estado
conductual biestable de activación que favorece el sueño o la vigilia
pero no las transiciones rápidas entre ambos. No es sorprendente
que la destrucción del núcleo POVL, con una lesión de los aminoá-
cidos excitadores que destruye los grupos celulares a la vez que deja
las fibras de paso intactas, produzca insomni
o 24.
Aunque las neuronas del POVL del hipotálamo preóptico
anterior generan el sueño NREM, las neuronas del tálamo también
alteran sus patrones de actividad eléctrica de manera muy imporante
durante el sueño NREM. Las neuronas reticulares talámicas talamo-
corticales comienzan a descargar en ráfagas. Este proceso genera
husos del sueño que son evidentes en el EEG. La descarga en ráfagas
de las neuronas talamocorticales produce de forma transitoria des-
aferentación de la corteza al desconectarla reversiblemente de los
estímulos sensitivos que se suelen transmitir hacia la corteza desde el
tálam
o 25. La desaferentación de la corteza por la actividad intrínseca
del tálamo recuerda a los estudios de lesiones de Bremer, en los que
la desaferentación permanente de la corteza formaba la base experi-
mental de la naturaleza pasiva del sueño. En conjunto, los patrones
Sueño, memoria y consciencia
7
1
Sección I
Fisiología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
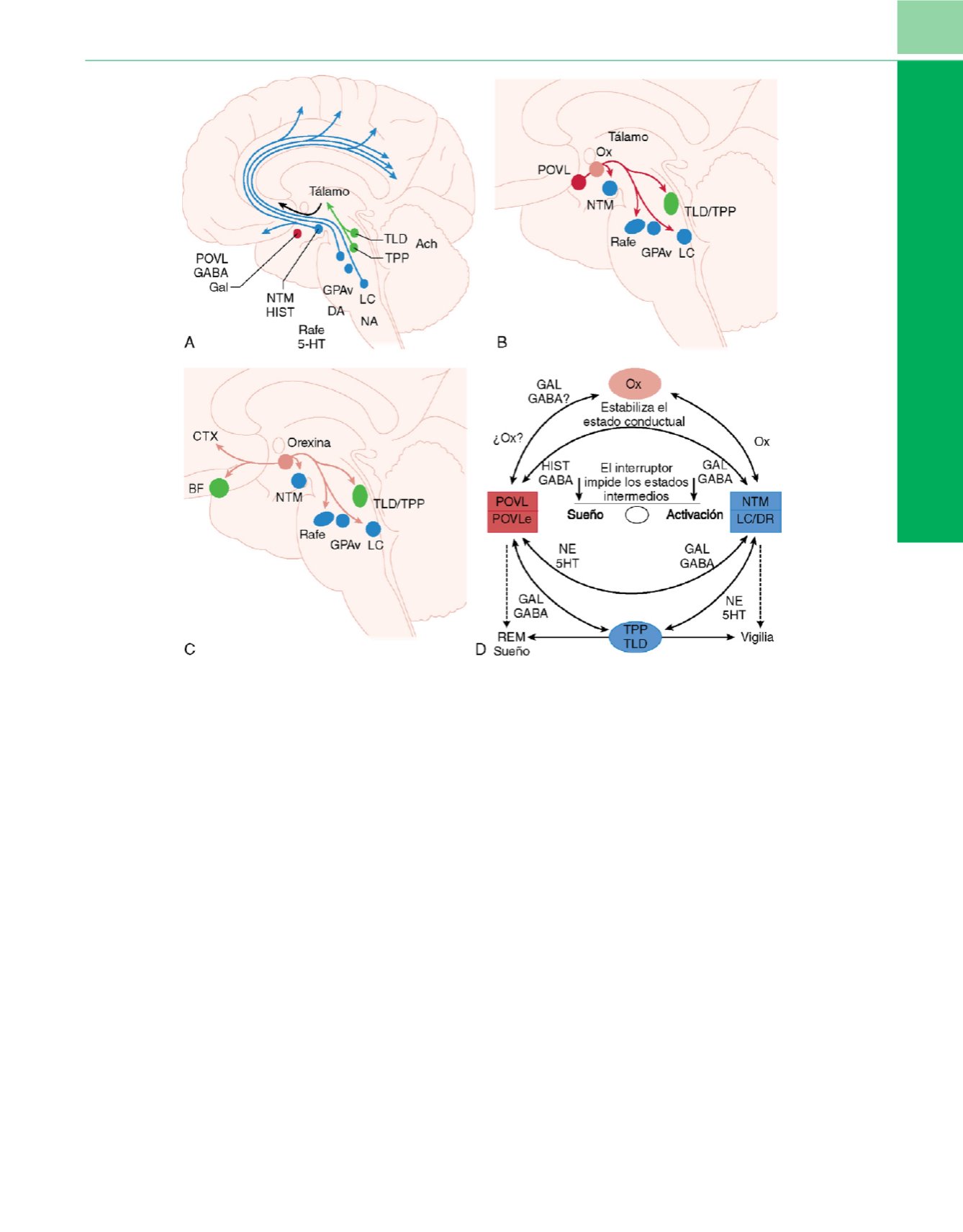
Figura 1-4
Regulación por el tronco encefálico y el hipotálamo del estado de activación.
A,
El sistema activador ascendente se origina en el tronco encefálico
y en el hipotálamo posterior, aunque envía proyecciones a todo el sistema nervioso central. Las neuronas colinérgicas del tegmento laterodorsal (TLD) y del
tegmento pedunculoprotuberancial (TPP) se proyectan hacia muchas dianas del prosencéfalo, como el tálamo, y se muestran en
azul
. Los centros
monoaminérgicos (en
verde
) envían proyecciones difusas a todo el prosencéfalo y modulan directamente los núcleos del hipotálamo. Estas regiones activas
durante la vigilia incluyen neuronas histaminérgicas del núcleo tuberomamilar (NTM), neuronas serotoninérgicas de los núcleos dorsal y medio del rafe (Rafe),
neuronas dopaminérgicas (DA) de la sustancia gris periacueductal ventral (GPAv) y neuronas noradrenérgicas (NA) del locus cerúleo (LC). En
rojo
se muestran
las neuronas promotoras del sueño del núcleo preóptico ventrolateral (POVL), que contienen los neurotransmisores inhibidores ácido
g
-aminobutírico y
galanina.
B,
Las proyecciones inhibidoras procedentes del POVL antagonizan la actividad de los centros activadores ascendentes.
C,
Las neuronas
orexinérgicas (ORX) están limitadas al hipotálamo posterior y lateral, aunque también se comunican con todos los centros de la activación conocidos para
fomentar y reforzar la estabilidad del estado de vigilia.
D,
Modelo en interruptor del control del estado de activación que da lugar a un circuito biestable en el
que la persona está predispuesta a la vigilia o al sueño pero no debe fluctuar entre los estados de activación.
(Modificada de Saper CB, Chou TC, Scammell TE.
The sleep switch: Hypothalamic control of sleep and wakefulness.
Trends Neurosci
24:726-731, 2001.)









