
de actividad del POVL y del tálamo ofrecen explicaciones mecánicas
de una red neuronal a favor de las teorías activa y pasiva del sueño.
Sueño REM
El control del sueño REM también está regulado por el encéfalo.
Aunque varios centros neuroanatómicos participan en la regulación
y la coordinación del inicio y el final del sueño REM, el principal
efector responsable de la generación del sueño REM reside en la
formación reticular protuberancial. Los estudios de transección de
Michel Jouvet (1925-) en gatos han permitido localizar mejor el
control del sueño REM en el tronco del encéfalo, en el núcleo protu-
berancial oral (PnO), que parece ser necesario para la expresión del
sueño REM. La inyección directa de agonistas colinérgicos en el PnO
(que es ligeramente rostral e inmediatamente ventral al LC) produce
un estado que simula al sueño RE
M 26 .El tono colinérgico endógeno
del tronco cerebral se origina en los núcleos TLD y TPP, dos núcleos
localizados en la unión entre la protuberancia y el mesencéfalo. Las
lesiones excitotóxicas que producen ablación de los núcleos TLD y
TPP producen un deterioro importante del sueño RE
M 27 .Un sub-
conjunto de neuronas de los núcleos TLD y TPP descarga de forma
selectiva durante el sueño REM, mientras que otras neuronas coli-
nérgicas de los núcleos TLD y TPP descarga durante el sueño REM
y la vigilia. De forma notable, el único subconjunto activo durante el
sueño REM aumenta su frecuencia de descarga antes de que aparez-
can las características EEG y conductuales de la expresión del sueño
RE
M 28,29 ,lo que indica que la actividad neuronal colinérgica de los
núcleos TLD y TPP puede iniciar el sueño REM (neuronas activas
en sueño REM). Las neuronas del núcleo POVL extendido (POVLe)
también tienen activación preferencial durante el sueño REM. Como
el núcleo POVLe se comunica directamente con las neuronas coli-
8
Fisiología y anestesia
I
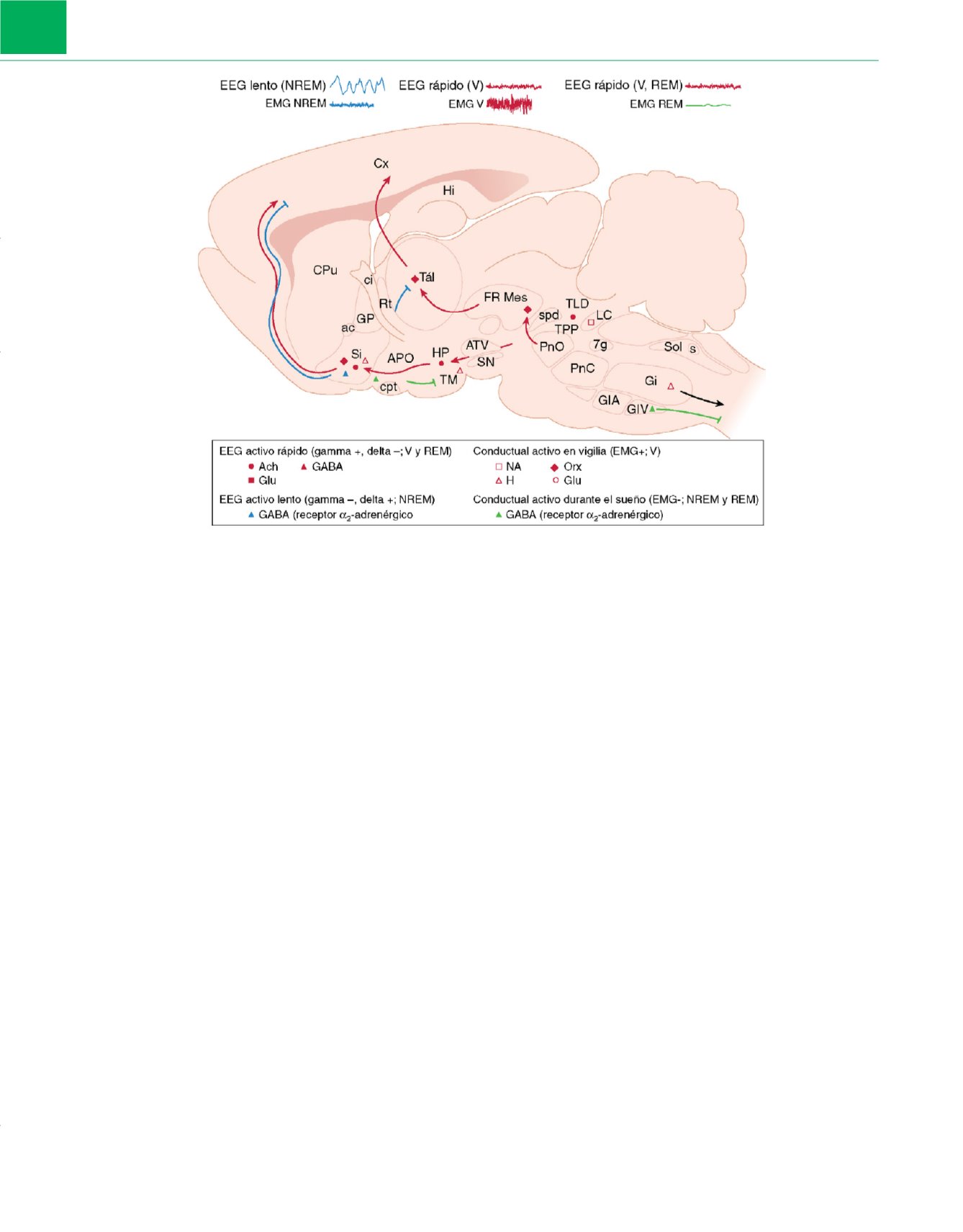
Figura 1-5
Corte esquemático a través de un encéfalo de rata que muestra las vías favorecedoras del sueño y la vigilia conservadas y sus correspondientes
sistemas de transducción de señales de neurotransmisores. Las neuronas que están activas durante la vigilia (V) incluyen las que tienen proyecciones ascendentes
hacia la corteza y que estimulan un EEG desincronizado de frecuencia rápida (gamma+), junto a proyecciones descendentes hacia la médula espinal que estimulan
el tono muscular postural necesario para la conducta de vigilia. Las neuronas activas en vigilia tienen su máxima actividad durante la vigilia, reducen llamativamente
su descarga durante el sueño no de movimientos oculares rápidos (NREM), y están prácticamente quiescentes durante el sueño de movimientos oculares rápidos
(REM). Los grupos de
símbolos de color rosa huecos
incluyen neuronas noradrenérgicas (NA), neuronas histaminérgicas (H), neuronas orexinérgicas (Orx) y neuronas
glutamatérgicas (Glu). Otras neuronas activas en vigilia que se muestran con
símbolos de color rosa rellenos
también están activas durante el sueño REM. Estos
sistemas en gran medida ascendentes incluyen neuronas colinérgicas (ACh), glutamatérgicas (Glu) y algunas neuronas que contienen ácido
g
-aminobutírico (GABA).
Las neuronas activas durante el sueño (
símbolos azules
y
verdes
) incluyen células cuyas proyecciones descendentes corticales atenúan la actividad cortical rápida, y
células con proyecciones descendentes hacia la médula espinal y el tronco encefálico, que reducen la activación conductual y el tono muscular. Las neuronas
activas durante el sueño descargan en asociación con una actividad EEG lenta (gamma–/delta+) durante el sueño NREM
(triángulo azul)
e incluyen algunas neuronas
GABAérgicas del prosencéfalo basal y del área preóptica (APO) que tienen receptores
a
2
-adrenérgicos y son inhibidas por la NA. Las neuronas talámicas GABAérgicas
del núcleo reticular descargan en ráfagas con husos y ondas lentas para inhibir y marcar el ritmo de las neuronas de interconexión talamocorticales. En el
prosencéfalo basal y el área preóptica, las neuronas GABAérgicas que expresan receptores
a
2
-adrenérgicos con proyecciones descendentes aumentan su
frecuencia de descarga a medida que disminuye el tono muscular (EMG–) durante el sueño NREM y REM
(símbolos verdes)
. Finalmente, otras neuronas GABAérgicas
(y/o posiblemente glicinérgicas) del bulbo raquídeo descienden directamente hacia la médula espinal, donde podrían inhibir a las neuronas motoras durante el
sueño. APO, área preóptica; ATV, área tegmental ventral; ca, comisura anterior; ci, cápsula interna; CPu, caudado y putamen; Cx, corteza; EEG,
electroencefalograma; EMG, electromiograma; FR Mes, FR mesencefálica; FR, formación reticular; 7g, rodilla del 7.° par craneal; Gi, FR gigantocelular; GiA, parte
gigantocelular, alfa, de la FR; GiV, parte gigantocelular, ventral de la FR; GP, globo pálido; Hi, hipocampo; HP, hipotálamo posterior; opt, tracto óptico; pcs, pedúnculo
cerebeloso superior; PnC, porción protuberancial, caudal, de la FR; PnO, parte protuberancial oral de la FR; Rt, núcleo reticular del tálamo; s, tracto solitario; SI,
sustancia innominada; SN, sustancia negra; Sol, núcleo del tracto solitario; Tál, tálamo; TLD, núcleo tegmental laterodorsal; TM, núcleo tuberomamilar; TPP, núcleo
tegmental pedunculoprotuberancial.
(Modificada de Jones BE: From waking to sleeping: Neuronal and chemical substrates.
Trends Pharmacol Sci
26:578, 2005.)









