
nérgicas del núcleo TLD del tronco encefálico y las neuronas mono-
aminérgicas del LC y de los NR, y como las lesiones del núcleo
POVLe reducen la cantidad de sueño REM, el núcleo POVLe parece
tener una participación especial en la generación del sueño RE
M 30 .La constelación conductual del sueño REM se puede disociar
en varios componentes, cada uno con sus propios mecanismos y
controladores neuroanatómicos específicos. Los signos cardinales del
sueño REM incluyen movimiento ocular rápido, atonía de todos los
grupos motores excepto el diafragma, y activación de un ritmo EEG
de voltaje bajo y frecuencia rápida. Los registros subcorticales mues-
tran ondas protuberanciales-geniculares-occipitales (PGO). Este
patrón característico de espigas en el EEG del sueño REM se origina
en la protuberancia, se transmite al núcleo geniculado lateral del
tálamo, y finaliza en la corteza occipital. La población de neuronas
de los núcleos TLD y TPP activas durante el sueño REM y la vigilia
con proyecciones rostrales es importante para la producción del EEG
desincronizado de frecuencia rápida y amplitud baja que se encuen-
tra tanto en la vigilia como en el sueño RE
M 26 .La atonía del sueño
REM se inicia en un grupo de neuronas reticulares de la protube-
rancia que establecen sinapsis en la formación reticular bulbar antes
de que su señal finalice en las neuronas motoras de la médula espinal.
El subconjunto de neuronas de la formación reticular protuberancial
que inician la atonía es una población no noradrenérgica de neuro-
nas adyacente al LC, llamada perilocus cerúleo alfa o subcerúleo
(SubC) en gatos, o núcleo sublateral dorsal (SLD) en roedore
s 31,32 .La salida del sueño REM puede ser una transición hacia el
sueño NREM o hacia la vigilia, y está desencadenada por grupos de
neuronas «inactivas en REM». La observación de que las neuronas
noradrenérgicas del LC reducen su frecuencia de descarga durante
el sueño NREM y están prácticamente quiescentes durante el sueño
REM, junto a estudios farmacológicos y de lesiones habían indicado
que la inhibición del LC era un requisito para la entrada en sueño
REM, y que las neuronas del LC podrían servir como células inacti-
vas en el sueño REM. Sin embargo, estudios genéticos en ratones con
deficiencia noradrenérgica han demostrado de manera concluyente
la existencia continua de un sueño REM normal o casi normal a
pesar de la ausencia de norepinefrin
a 33,34. Así, las neuronas adrenér-
gicas del LC no pueden ser una población exclusiva inactiva en sueño
REM. Las neuronas de la sustancia gris periacueductal ventrolateral
(GPAvl) también ponen fin a los episodios de sueño REM, como se
ha demostrado en estudios farmacológicos en los cuales la inhibición
de esta región por muscimol aumenta el sueño REM, y también en
elegantes estudios de cartografía inmunohistoquímica combinada
con lesiones de la GPAv
l 35–37. Las neuronas de la GPAvl forman un
inhibidor con antagonismo mutuo con las neuronas del núcleo SLD
para generar o inhibir de forma eficiente el sueño RE
M 35 .Transiciones entre estados de activación
inducidas por somnógenos
Aunque los patrones del EEG y el EMG corticales y la actividad de los
centros activos durante el sueño o la vigilia del tronco encefálico, el
hipotálamo y el tálamo son bien conocidos durante los estados de
sueño y vigilia, los mecanismos responsables de la entrada o la salida
de un estado determinado siguen siendo unmisterio.Neurocientíficos
franceses y japoneses propusieron de forma independiente la teoría
humoral de la regulación del sueño hace casi 100 años. La infusión
intratecal del líquido cefalorraquídeo (LCR) obtenido de perros con
privación de sueño en perros con un descanso normal hacía que los
perros que habían descansado se durmieran rápidament
e 38,39. Estos
resultados indicaron la existencia de un somnógeno endógeno, una
«hormona» que circulaba en el LCR y cuya acumulación podría pro-
ducir el inicio del sueño.A lo largo del siglo pasado la lista de posibles
somnógenos ha crecido e incluye sustancias tan diversas como pro-
teínas (péptido
d
inductor del sueño [DSIP
] 40 ), lípidos (
cis
-9,10-octa-
decenoamid
a 41), hormonas (melatonina), citocinas (interleucina-1),
eicosanoides (prostaglandina D
2
[PGD
2
]) y un nucleósido, la ade-
nosin
a 42 .Vamos a revisar los datos de estos dos últimos posibles
somnógenos, que han sido sometidos a mayor estudio.
La infusión de concentraciones femtomolares de PGD
2
en el
tercer ventrículo induce sueño tanto NREM como REM en ratas que
es indistinguible del sueño natura
l 43 .La concentración de PGD
2
fluctúa
en el LCR, con una frecuencia circadiana paralela a la de los ciclos de
sueño y vigilia. La privación de sueño eleva de manera proporcional la
concentración de PGD
2
en el LCR, lo que confirma la participación de
la PGD
2
como somnógeno endógeno. La PGD
2
es sintetizada por la
enzima prostaglandina D sintetasa,que está localizada en lamembrana
aracnoidea y el plexo coroideo
( fig. 1-6), y es secretada directamente
hacia el LCR, donde es la segunda proteína más abundante. Estudios
de microdiálisis confirman una actividad específica promotora del
sueño de cantidades picomolares de PGD
2
. Sin embargo, esta actividad
somnógena está presente sólo cuando se infunde PGD
2
cerca del área
preóptica del hipotálamo. La actividad más pronunciada de la PGD
2
Sueño, memoria y consciencia
9
1
Sección I
Fisiología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
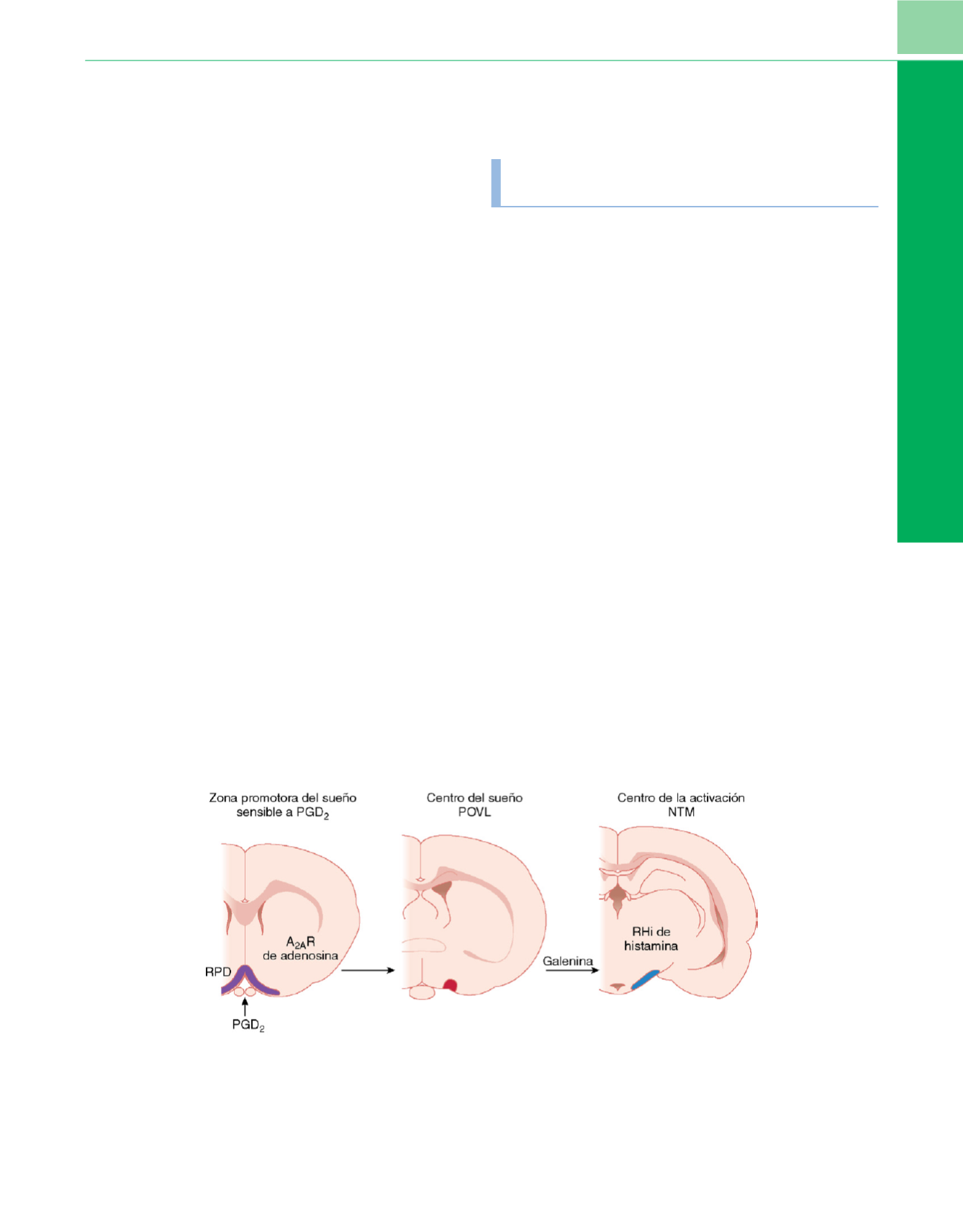
Figura 1-6
Mecanismos moleculares de la aparición del sueño por el somnógeno endógeno prostaglandina D
2
(PGD
2
). El receptor de la prostaglandina D
2
(RPD) tapiza la superficie ventral del prosencéfalo basal y el área preóptica
(área morada)
. Se piensa que el RPD transmite la señal somnógena de la PGD
2
desde el líquido cefalorraquídeo hasta el núcleo preóptico ventrolateral (POVL, en
rojo
), y se utiliza la adenosina como molécula de transducción de señales.
Este fenómeno de transducción de señales activa las neuronas del POVL a través del receptor A
2A
de la adenosina, lo que da lugar a la inhibición de grupos
histaminérgicos activos durante la vigilia, como el núcleo tuberomamilar (NTM, en
azul
).
(Modificada de Hayaishi O, Urade Y: Prostaglandin D
2
in sleep-wake
regulation: Recent progress and perspectives.
Neuroscientist
8:12, 2002.)









