
se observa cuando se infunde debajo del núcleo POVL. La infusión de
un antagonista de la PGD
2
en el tercer ventrículo inhibe de forma
reversible y dependiente de la dosis el sueño tanto REM como NREM
(v. una revisión en Hayaishi y Urad
e 43 ). Tras su unión al receptor de
prostanoides de tipo D (RPD), que está localizado en la membrana
aracnoidea que recubre la superficie ventral del encéfalo, la señal som-
nogéna de la PGD
2
parece transducirse indirectamente a través de la
activación del núcleo POV
L 44 .El mecanismo de la activación del
POVL después de la infusión subaracnoidea de PGD
2
parece precisar
adenosina, porque la administración simultánea de un antagonista del
receptor A
2a
de la adenosina bloquea la actividad somnógena de la
PGD
2
. Por el contrario, la administración de un agonista del receptor
A
2a
de la adenosina simula la actividad somnógena de la PGD
2 45 .A medida que se acumulan las concentraciones de adenosina, éstas
activan las neuronas que expresan el receptor A
2a
para activar directa
o indirectamente el núcleo POV
L 46. Por tanto, parece que la adenosina
puede actuar como el neurotransmisor que acopla los mecanismos
humoral y neural que dirigen la regulación del ritmo sueño-vigilia.
Con este modelo, el impulso homeostático que lleva al sueño se
acumula proporcionalmente para producir aumentos de los somnóge-
nos endógenos PGD
2
y adenosina. La existencia de estas sustancias
somnógenas que se acumulan con el tiempo habla a favor de la gene-
ración activa, y no pasiva, del sueño.
Anestesia y sueño
La anestesia es un estado que comparte similitudes fenotípicas con el
sueño, por lo que con frecuencia se utiliza la metáfora de «ir a dormir»
para describir la inducción de la anestesia general en el contexto
clínic
o 47 .La anestesia y el sueño no son sólo estados similares, sino
que también comparten rasgos neurobiológicos comune
s 48 ;de hecho,
el componente hipnótico de la anestesia se puede deber a acciones
específicas de los anestésicos sobre los sistemas neurales que regulan
el sueño natural. Esta hipótesis está respaldada por diversos estudios.
Durante el sueño y la anestesia general se produce una reducción de
la sensibilidad a los estímulos externos. En estudios de imágenes fun-
cionales del encéfalo durante la inconsciencia inducida por anestési-
cos se ha demostrado que se inhiben los núcleos del tálamo y de la
formación reticular del mesencéfal
o 49. El bloqueo por los anestésicos
de la transferencia de información desde el tálamo, que impide que
las aferencias somatosensitivas lleguen a los centros corticales supe-
riores, también se ha confirmado mediante registros más directos con
microelectrodo
s 50,51. En ambos casos, los efectos de estos anestésicos
sobre el tálamo son similares a la inhibición talamocortical que se
produce de forma natural y que es característica del sueño NRE
M 25 .Privación de sueño
La privación de sueño potencia la acción hipnótica de los anestésicos,
como el propofol y el isofluran
o 52 .Además, la deuda de sueño, que
en otro caso se produciría después de la privación de sueño, se disipa
durante la anestesia con propofol; sin embargo, aún se desconoce si
dosis hipnóticas de propofol podrían mejorar también otras carac-
terísticas de la privación del sueño (p. ej., sobre la función inmuni-
taria
) 53 .El monitor de índice biespectral, diseñado para monitorizar
la profundidad de la hipnosis inducida por anestésicos, también
parece ser útil para registrar el inicio y la profundidad del sueñ
o 54 .Somnógenos endógenos y anestésicos
La infusión de adenosina a dosis bajas potencia las acciones hip-
nóticas de los anestésicos intravenosos y volátiles, reduciendo así
la cantidad de anestésico necesaria para alcanzar una profundidad
determinada de anestesia. Este efecto se produce con 2-cloroade-
nosina, un potente análogo de la adenosina, y con dipiridamol, un
inhibidor de la recaptación de la adenosina y un inhibidor de la
adenosina desaminasa. Por el contrario, la administración de teo-
filina, un antagonista adenosinérgico, produce resistencia parcial a
la anestesi
a 55 .Desde una perspectiva mecánica, estos datos encajan
bien con el efecto de la adenosina sobre la activación del centro del
sueño del hipotálamo, el núcleo POVL (v. la explicación siguiente).
Mientras tanto, la exposición a anestésicos como el isoflurano
afecta a las concentraciones de somnógenos endógenos, de modo
que el isoflurano altera el equilibrio en el hipotálamo entre la pros-
taglandina E
2
, una prostaglandina que favorece la vigilia, y la PGD
2
,
una prostaglandina inductora del sueño
56 .Efectos de los anestésicos
sobre los circuitos del sueño
El conocimiento de los sistemas de activación endógenos es un pre-
rrequisito esencial para cualquier explicación de los mecanismos de
acción de los psicoestimulantes, los sedantes-hipnóticos y los anesté-
sicos generales. Las acciones predichas de los anestésicos sobre la base
de sus efectos conocidos en células individuales que expresan recep-
tores de neurotransmisores recombinantes únicos, como los recepto-
res GABAérgicos, glutamatérgicos, colinérgicos, adrenérgicos, his
taminérgicos, serotoninérgicos y orexinérgicos y los canales de calcio,
sodio o potasio activados por voltaje, permiten generar hipótesis
verificables. Sin embargo, los anestésicos se distribuyen por todo
el encéfalo
( fig. 1-7 ) 57 ,y como, en su mayoría, los núcleos activos
10
Fisiología y anestesia
I
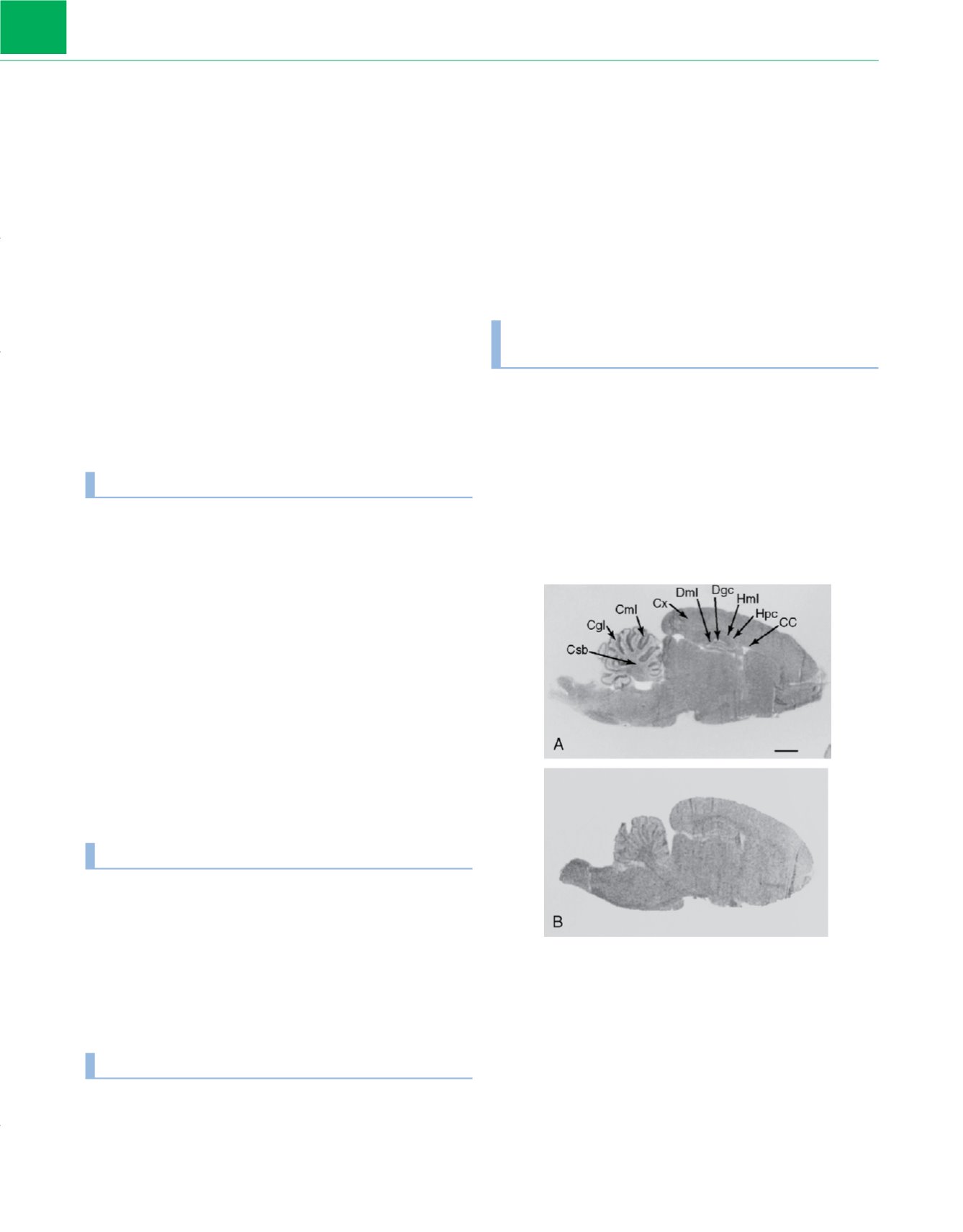
Figura 1-7
Distribución de la unión específica del halotano en el encéfalo de rata.
A,
Este autorradiograma muestra la unión casi homogénea del anestésico volátil
halotano a una concentración de 100
m
M mediante marcado de fotoafinidad
directo con
14
C-halotano. Se observan algunas excepciones a la captación casi
uniforme en la sustancia blanca del cerebelo (Csb), la capa granular del cerebelo
(Cgl) y algunas regiones del hipocampo.
B,
La unión específica es inhibida
competitivamente por halotano no radiactivo 2,3mM. CC, cuerpo calloso;
Cml, capa molecular del cerebelo; Cx, corteza; Dgc, capa de células granulares del
dentado; Dml, capa molecular del dentado; Hcp, capa de células piramidales del
hipocampo; Hml, capa molecular del hipocampo.
(Modificada de Eckenhoff MF,
Eckenhoff RG: Quantitative autoradiography of halothane binding in rat brain.
J Pharmacol Exp Ther
285:371, 1998.)









