
al corazón izquierd
o 7. Sin embargo, debido al pronunciado gra-
diente arteriovenoso de Po
2
, este cortocircuito es parcialmente
responsable del gradiente a-a normal de O
2
de 5-10 mmHg que se
observa en niños y adultos jóvenes que respiran aire ambiente. El
cortocircuito provocado por estas circulaciones puede aumentar al
10% del gasto cardíaco en presencia de una enfermedad bronquial
grave y de coartación aórtic
a 9 .La heterogeneidad normal de V˙ /Q˙
en todo el pulmón es el otro factor que contribuye al gradiente a-a
basal. El gradiente aumenta con la edad, probablemente por la
mayor capacidad de cierre y la dispersión de la relación V˙ /Q˙
7.
Un cortocircuito derecha-izquierda patológico de sangre se
produce en las áreas de atelectasia o de bloqueo de la vía respirato-
ria, como en la lesión pulmonar aguda (LPA) o en la neumonía. Los
alveolos se colapsan o no se ventilan, pero mantienen su perfusión.
El drenaje venoso de los tumores pulmonares también constituye
un cortocircuito patológico. Si la vasoconstricción pulmonar
hipóxica (VPH) no logra limitar de forma adecuada el flujo a estas
regiones, se produce hipoxemia. De hecho, se sabe que los anesté-
sicos inhalatorios producen una atenuación de la VPH, y la induc-
ción de la anestesia general (AG) provoca el desarrollo inmediato
de atelectasia (v. cap. 5
) 12,13. Es probable que ambos contribuyan al
cortocircuito del 5-10% observado en pacientes sometidos a AG
con ventilación mecánic
a 10 .Cálculo de la fracción de cortocircuito y del espacio muerto
Un modelo simplificado, pero útil, de pulmón tricompartimental
ayuda a establecer una aproximación de qué fracción del gasto
cardíaco (Q˙ t) corresponde al cortocircuito (Q˙ s) y qué fracción del
volumen corriente (Vc) a la ventilación del espacio muerto (V˙ em).
Este modelo, denominado planteamiento de Riley, considera al
pulmón como si estuviese constituido por tres compartimentos en
los tres extremos de la relación V˙ /Q˙ :1) un compartimento de cor-
tocircuito con alveolos perfundidos pero no ventilados, 2) un com-
partimento de espacio muerto con alveolos ventilados pero no
perfundidos y 3) un compartimento ideal con una distribución
normal de ventilación y perfusión (
fig. 34-3 ).
Como ya se ha descrito antes, el pulmón está compuesto en
realidad por muchos compartimentos con una amplia distribución
de relaciones V˙ /Q˙ y este es un modelo hipersimplificado, pero de
gran utilidad clínica.
La fracción de cortocircuito (Q˙ s/Q˙ t) puede calcularse utili-
zando la ecuación de cortocircuito de Berggren para comparar el
contenido de O
2
de la sangre venosa mixta Cv¯ o
2
, capilar pulmonar
(Cc'o
2
) y arterial (Cao
2
):
Q˙ s/Q˙ t = (Cc
9
o
2
− Cao
2
)/(Cc
9
o
2
−Cv– o
2
)
(10)
En una persona sana con una saturación capilar de O
2
cercana al 100%, se puede hacer la siguiente aproximación:
Q˙ s/Q˙ t = (1−Sao
2
)/(1−Sv– o
2
)
(11)
donde Sv– o
2
y Sao
2
son las saturaciones venosa mixta y arterial de
O
2
, respectivamente.
1180
Control de la anestesia
III
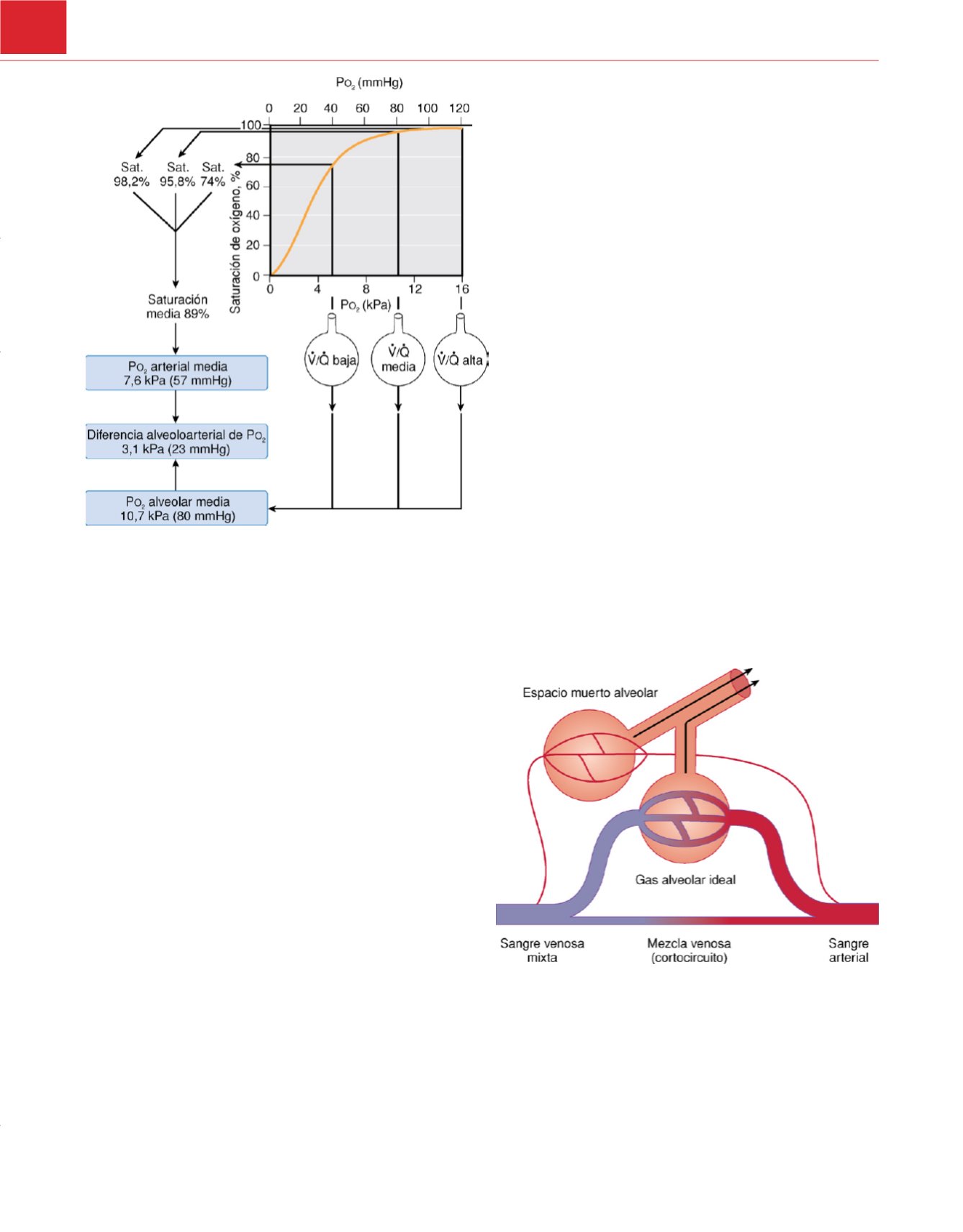
Figura 34-2
Diferencia alveoloarterial de P
o
2
causada por la dispersión de las
relaciones V˙ /Q˙ , lo que da lugar a presiones de oxígeno a lo largo del punto de
inflexión superior de la curva de disociación del oxígeno. El diagrama muestra el
efecto de tres grupos de alveolos con valores de P
o
2
de 5,3, 10, 7 y 16 kPa (40,
80 y 120 mmHg). Si se ignora el efecto de los distintos volúmenes de gas y
sangre con los que contribuyen los tres grupos, la P
o
2
alveolar media es de
10,7 kPa. Sin embargo, debido a la forma de la curva de disociación, la
saturación de la sangre que sale de cada grupo no es proporcional a su P
o
2
. En
realidad, la saturación arterial media es del 89%, por lo que la P
o
2
es de 7,6 kPa.
Por consiguiente, la diferencia alveoloarterial de P
o
2
es de 3,1 kPa. La diferencia
real sería un poco mayor, porque el gas con una P
o
2
elevada tendría una
contribución relativamente mayor al gas alveolar y la sangre con una baja P
o
2
tendría una contribución relativamente mayor a la sangre arterial. En este
ejemplo, se requeriría una mezcla venosa calculada del 27% para justificar la
dispersión de las relaciones V˙ /Q˙ en términos de la diferencia alveoloarterial
medida de P
o
2
a una P
o
2
alveolar de 10,7 kPa.
(De Lumb AB:
Nunn’s Applied
Respiratory Physiology,
6.
a
ed. Filadelfia, Elsevier/Butterworth Heinemann, 2005.)
Figura 34-3
Modelo tricompartimental (de Riley) del intercambio gaseoso. Se
supone que el pulmón consta de tres unidades funcionales, que son el espacio
muerto, los alveolos «ideales» y la mezcla venosa (cortocircuito). El intercambio
gaseoso se produce sólo en los alveolos «ideales». El espacio muerto medido
consta del verdadero espacio muerto alveolar junto con un componente
causado por la dispersión V˙ /Q˙ . La mezcla venosa medida consta de la mezcla
venosa verdadera (cortocircuito) junto con un componente causado por la
dispersión V˙ /Q˙ . Obsérvese que el gas alveolar «ideal» se espira contaminado
con gas del espacio muerto alveolar, por lo que no es posible tomar una
muestra del gas alveolar «ideal».
(De Lumb AB:
Nunn’s Applied Respiratory
Physiology,
6.
a
ed. Filadelfia, Elsevier/Butterworth Heinemann, 2005.)









