
intenso malestar, los escalofríos y la activación del sistema nervioso
autónom
o 185 .Por tanto, se debe instituir el enfriamiento activo de
los pacientes, intensificando la vigilancia para garantizar que los
posibles beneficios superen al estrés inducido por la activación de
las defensas termorreguladoras.
Hipertermia durante la analgesia epidural
La hipertermia suele complicar la analgesia epidural en pacientes
en proceso de dilatación y part
o 186y en pacientes postoperatorias
no embarazada
s 187 .Es más probable cuando se prolonga la fase de
dilatación (es decir,
>
8 horas). Una consecuencia clínica de esta
hipertermia es que las mujeres tratadas con analgesia epidural
reciben antibióticos con más frecuencia que las tratadas de forma
convencional y sus hijos suelen recibir con más frecuencia trata-
miento para la sepsi
s 188 .Debido a que la hipertermia pasiva y la excesiva producción
de calor son etiologías poco probables, es de suponer que la eleva-
ción de la temperatura corporal en el parto y en pacientes posto-
peratorias sea auténtica fiebre (es decir, un incremento regulado de
la temperatura central) resultante de una infección o inflamació
n 189 .Por ejemplo, Dashe y cols. concluyeron que «la analgesia epidural
se asocia con fiebre intraparto, pero sólo en presencia de inflama-
ción placentaria, lo que sugiere que la fiebre descrita con la analge-
sia epidural se debe a infección más que a la propia analgesia
» 189 .El supuesto convencional es que la hipertermia está
causada
por la técnica, aunque no se ha propuesto ningún mecanismo
convincente. Sin embargo, es útil recordar que el dolor en las
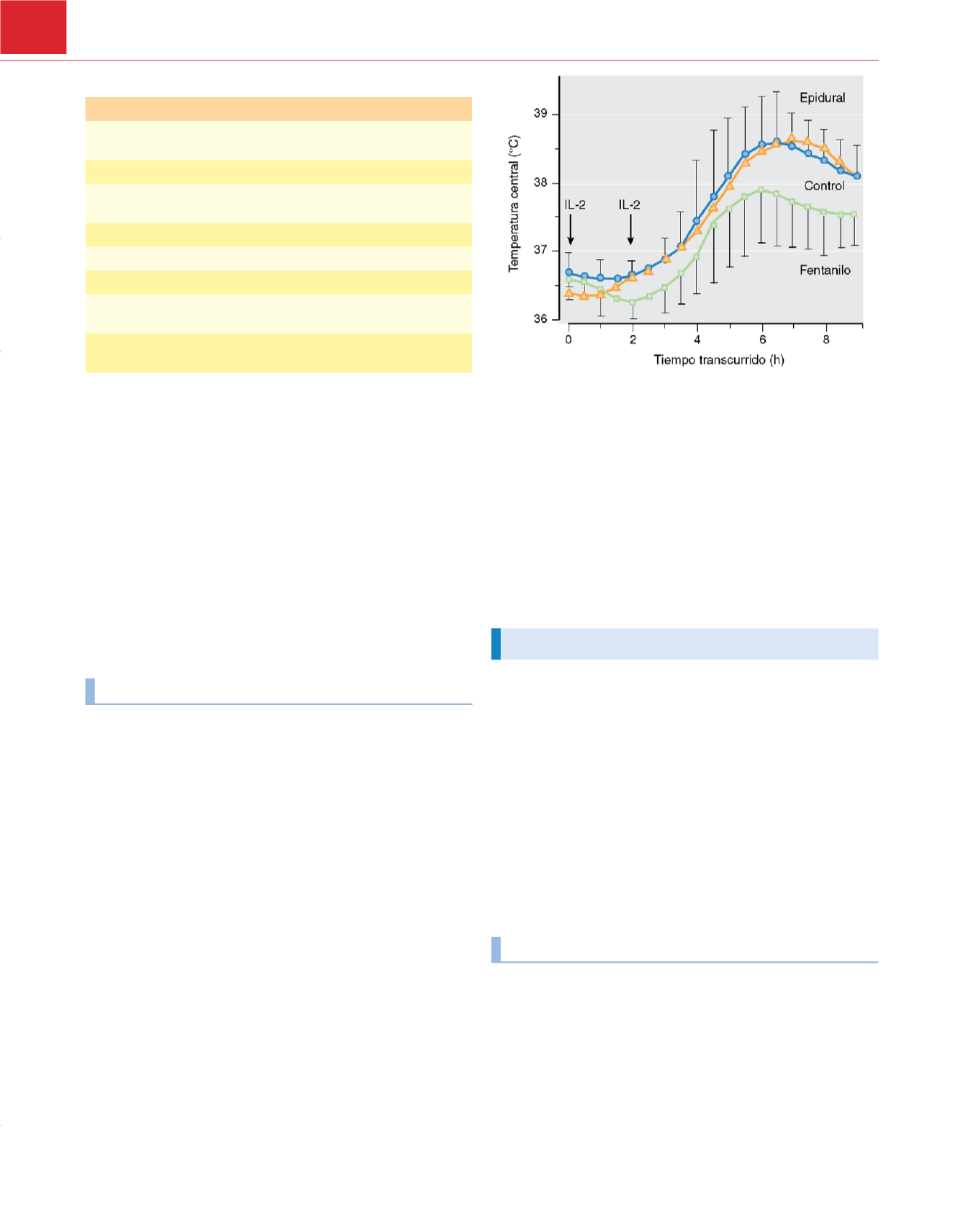
pacientes «control» suele tratarse con opioides, que por sí mismos
atenúan la fiebr
e 178 .La fiebre asociada con la infección o el daño
tisular podría así ser suprimida por las bajas dosis de opioides que
se suelen administrar a las pacientes «control», mientras que se
manifestaría normalmente en las pacientes que reciben analgesia
epidural
( fig. 38-20 ) 190 .El grado de contribución de este meca-
nismo está por determinar y es motivo de controversi
a 191 ,pero no
se ha propuesto ninguna explicación alternativa convincente.
Monitorización de la temperatura
Las mediciones de la temperatura central (p. ej., membrana timpá-
nica medica con un termopar, arteria pulmonar, porción distal del
esófago y nasofaringe) se emplean para controlar la hipotermia
intraoperatoria, evitar el sobrecalentamiento y facilitar la detección
de hipertermia maligna. Las temperaturas del músculo o de la
superficie cutánea se pueden usar para evaluar la motilidad vascu-
la
r 192y asegurar la validez del control neuromuscular periféric
o 193.
Se requieren ambas mediciones (central y superficie cutánea)
para determinar los efectos termorreguladores de los diferentes
fármacos anestésicos. La combinación de la temperatura central y
la temperatura cutánea media puede usarse para estimar la tempe-
ratura corporal (y, por tanto, el contenido de calor corporal), con
una precisión notabl
e 194 .Las temperaturas no son uniformes en
todo el cuerpo; por consiguiente, las temperaturas medidas en cada
sitio tienen diferente significado fisiológico y práctico.
Termómetros
Los termómetros de mercurio son lentos e incómodos, por lo que
han sido reemplazados por sistemas electrónicos. Los termómetros
electrónicos más frecuentes son termistores y termopares. Ambos
son lo suficientemente precisos para el uso clínico, y bastante
baratos para ser desechables. También son suficientemente precisos
para este uso los termómetros de «tejidos profundos» basados en
la reducción activa a cero del flujo cutáneo de calo
r 195 ;por desgra-
cia, actualmente no se dispone de estos monitores ni en Europa ni
en Estados Unidos. Los termómetros timpánicos de infrarrojos que
1316
Control de la anestesia
III
Figura 38-20
Temperaturas centrales después de la administración de 50UI/g
de interleucina 2 (IL-2), seguida por una segunda dosis de 100UI/g 2 horas más
tarde. La primera dosis de IL-2 se definió como tiempo cero. Los datos se
presentan como media±DE. Las barras de error de los datos de la anestesia
epidural se han omitido para mejorar la claridad de la figura, pero fueron
similares a los presentados para los controles y para fentanilo intravenoso.
(De Negishi C, Lenhardt R, ozaki M y cols.: Opioids inhibit febrile responses in
humans, whereas epidural analgesia does not: An explanation for
hyperthermia during epidural analgesia.
Anesthesiology
94:218-222, 2001.)
Tabla 38-3
Enfriamiento cutáneo activo como tratamiento de la fiebre
Control
Enfriamiento Calentamiento
Temperatura central
integrada (°C/h)
6,0±1,6 5,7±2,2
6,4±1,2
Consumo de oxígeno (ml/min) 330±50 430±4
0 *310±30
Duración de los escalofríos
(min)
33±11 229±35
20±0
Presión arterial media (mmHg) 90±4 98±
6 *86±
6 †Media [norepinefrina] (nM)
1,0±0,4 1,4±0,
7 *1,1±0,
5 †[Epinefrina] basal (nM)
0,3±0,1 0,3±0,1
0,3±0,1
Media de [epinefrina]
durante el tratamiento (nM)
0,3±0,1 0,5±0,
1 *0,4±0,1
Sensación intensa de frío (%
del tiempo)
27
8
9 *11
Los voluntarios recibieron 30.000UI/kg de interleucina 2 (IL-2), seguido 2 horas más
tarde por otra dosis de 70.000UI/kg. La primera dosis de IL-2 definió el tiempo cero
del período de tiempo. El tratamiento térmico comenzó después de 3 horas y con-
tinuó durante 5 horas. Cada voluntario participó en 3 días diferentes: sin enfriami-
ento ni calentamiento, enfriamiento activo y calentamiento activo. Se presentan los
valores medios e integrados en el período de tratamiento, entre las 3 y las 8 horas
del período de estudio. Los tiempos se presentan en horas transcurridas desde la
primera inyección de IL-2. Los datos se presentan como medias±DE.
*Diferencias estadísticamente significativas respecto al control.
†
Diferencias estadísticamente significativas respecto al día de enfriamiento.
De Lenhardt R, Negishi C, Sessler DI y cols.: The effects of physical treatment on
induced fever in humans.
Am J Med
106:550-555, 1999.









