
La falta de eficacia durante este período se produce porque el flujo
de calor desde el centro a la periferia es masivo y porque la trans-
ferencia del calor cutáneo aplicado requiere casi una hora hasta
llegar al centro, incluso en pacientes vasodilatados.
Aunque la redistribución no puede tratarse de manera efi-
ca
z 56 ,se puede evitar. La redistribución se produce cuando la
vasodilatación inducida por anestésicos permite que el calor fluya
a la periferia según el gradiente normal de temperatura. El calen-
tamiento de la superficie cutánea antes de la inducción de la
anestesia no altera de forma significativa la temperatura central
(que permanece bien regulada), pero sí incrementa el contenido
de calor corporal. Gran parte del aumento sucede en las piernas,
el componente principal del compartimento térmico periférico.
Cuando la temperatura de los tejidos periféricos aumenta lo sufi-
ciente, la inhibición posterior de la vasoconstricción termorregu-
ladora tónica normal produce poca hipotermia por redistribución,
porque el calor sólo puede fluir según un gradiente de tempera-
tura
( fig. 38-17 ) 69,70 .Aunque hay que transferir cantidades sustan-
ciales de calor a través de la superficie cutánea, el precalentamiento
activo durante tan sólo 30 minutos tal vez evite una redistribu-
ción considerabl
e 140.
La «recaída» asociada con la interrupción de la circulación
extracorpórea (CEC) es un tipo de hipotermia por redistribución,
originada por un sustancial gradiente de temperatura tisular del
centro a la periferia. Como sería de esperar, es más llamativo
después de una CEC a 17 °C
141que a 27-31 °
C 142. El calentamiento
cutáneo durante y después de la CEC reduce la recaída de la tem-
peratura central en un 60%. Sin embargo, los datos del balance
calórico indican que esta reducción se produce principalmente
porque el calentamiento cutáneo evita la disminución típica del
contenido de calor corporal tras la interrupción de la CEC más que
por una reducción de la redistribució
n 143 .Calentamiento y humidificación de la vía
respiratoria
Unos cálculos termodinámicos sencillos indican que menos del
10% de la producción metabólica de calor se pierde a través de las
vías respiratorias. La pérdida es el resultado del calentamiento y la
humidificación de los gases inspiratorios, pero la humidificación
requiere dos tercios del calo
r 50 .Dado que se pierde poco calor por
la respiración, el calentamiento y la humidificación activos de las
vías respiratorias influyen de forma mínima en la temperatura
centra
l 56 .Debido a que la pérdida de calor respiratorio permanece
casi constante durante la anestesia, la fracción de la pérdida total
de calor a través de las vías respiratorias disminuye en gran
medida durante operaciones extensas en las que se pierde una
considerable cantidad de calor por evaporación desde las incisio-
nes quirúrgica
s 51. Por consiguiente, el calentamiento y la humidi-
ficación de las vías respiratorias son incluso menos eficaces de lo
habitual en los pacientes, sobre todo en los que necesiten un
calentamiento eficaz.
Líquidos intravenosos
No es posible calentar a los pacientes mediante la administración
de líquidos calientes, pues éstos no pueden exceder (mucho) la
temperatura corporal. Por otra parte, la pérdida de calor por líqui-
dos intravenosos fríos cobra relevancia cuando se administran
grandes cantidades de soluciones de cristaloides o de sangre. Una
unidad de sangre refrigerada o 1 l de solución cristaloide adminis-
trados a temperatura ambiente, reducen la temperatura corporal
media aproximadamente 0,25 °C. (La sangre está el doble de fría,
pero aporta sólo la mitad de volumen.) Los calentadores de líqui-
dos minimizan estas pérdidas y deberían usarse cuando se vayan
a administrar grandes cantidades de sangre o líquidos intraveno-
sos, pero su contribución es menos importante cuando los volú-
menes son menores.
Para los casos habituales no hay diferencias clínicas signifi-
cativas entre los calentadores disponibles. Aunque la mayoría de
los calentadores permiten el enfriamiento del líquido en las
conexiones entre el calentador y el paciente, este enfriamiento tiene
escasas consecuencias en adultos: a flujos altos se produce poco
enfriamiento y a flujos bajos la cantidad de líquido administrado
es muy pequeña
144 .Hay sistemas especiales de alto volumen con
calentadores potentes y baja resistencia al flujo que facilitan el
cuidado de las víctimas de traumatismos y son útiles en aquellos
casos en los que se deba administrar una gran cantidad de líquidos
con rapidez.
Calentamiento cutáneo
La temperatura del quirófano es el principal factor que influye en
la pérdida de calor, porque determina el ritmo al cual se pierde el
calor metabólico por radiación y convección desde la piel y por
evaporación desde las incisiones quirúrgicas. Por tanto, el aumento
de la temperatura ambiente es una vía para minimizar la pérdida
de calor. Sin embargo, por lo general se requiere una temperatura
ambiente que exceda los 23 °C para mantener la normotermia en
los pacientes sometidos a cualquier procedimiento, a excepción de
las pequeñas intervencione
s 145 .La mayor parte del personal de
quirófano encuentra esas temperaturas incómodas por el calor. Los
lactantes pueden necesitar temperaturas ambiente que excedan los
26 °C para mantener la normotermia. Tales temperaturas son lo
1312
Control de la anestesia
III
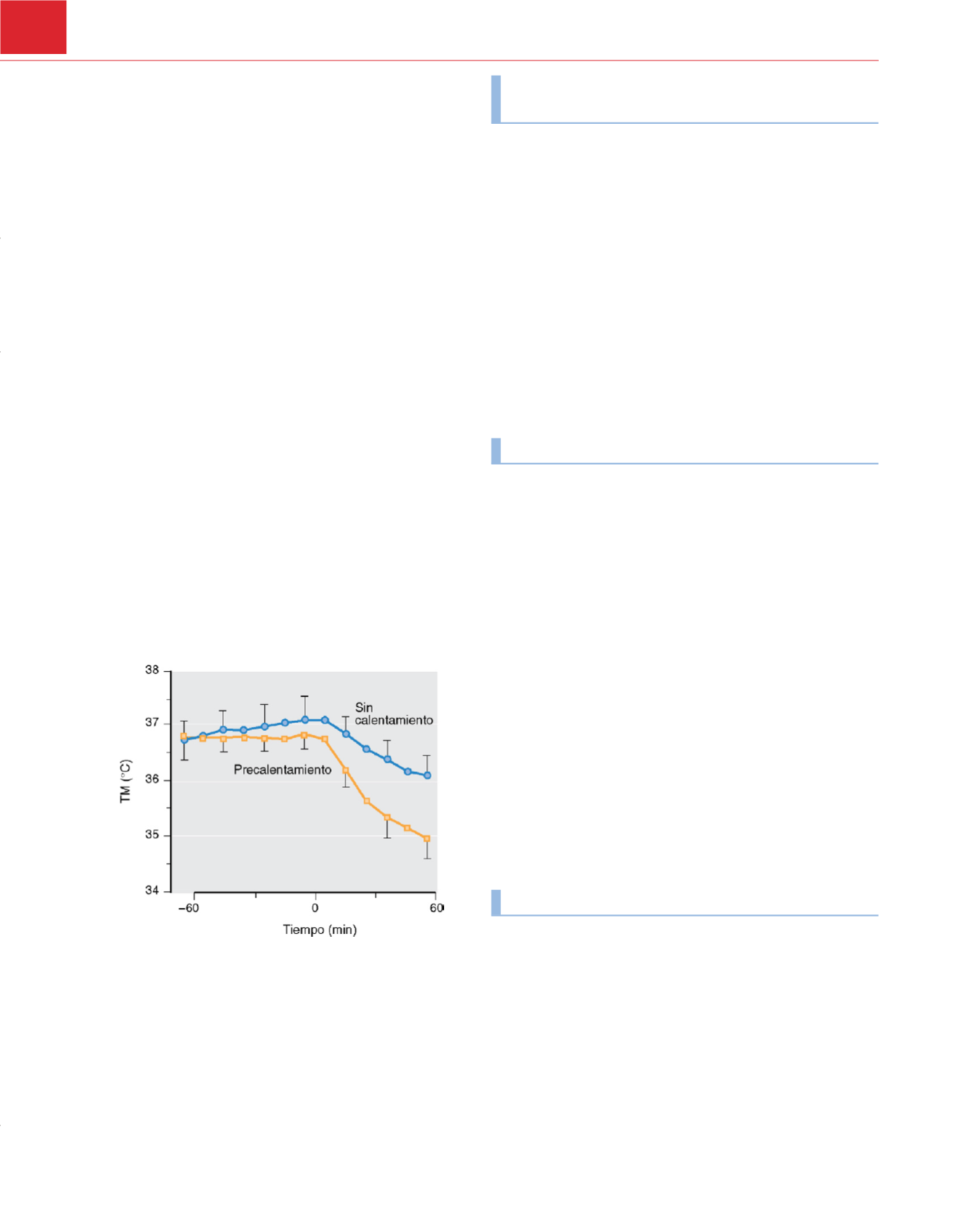
Figura 38-17
Durante el período de preinducción (–120 a 0 minutos), se
calentó de forma activa o se enfrió de modo pasivo (sin calentamiento) a
voluntarios. En la inducción de la anestesia (tiempo=0 minutos), se
interrumpió el calentamiento activo y se expuso a los voluntarios al ambiente.
Las temperaturas iniciales de la membrana timpánica fueron similares antes
de cada tratamiento de preinducción. Durante los 60 minutos tras la
inducción de la anestesia, la temperatura central disminuyó menos en los
voluntarios que habían sido precalentados. (
∆
T=–1,1±0,3°C) que en los no
calentados (
∆
T=–1,9±0,3°C). Los datos se presentan como medias±DE).
(De Hynson JM, Sessler DI, Moayeri A y cols.: The effects of pre-induction
warming on temperature and blood pressure during propofol/nitrous oxide
anesthesia.
Anesthesiology
79:219-228, 1993.)









