
Vía común de la coagulación
La vía final, común a la cascada tanto extrínseca como intrínseca,
representa la generación de trombina y la formación posterior de
fibrina. La amplificación de señales a través de ambas vías culmina
en la formación de los complejos de protrombinasa (complejos de
activación unidos a los fosfolípidos de membrana), incluido el
factor Xa, el factor II (protrombina), el factor Va (cofactor) e iones
calci
o 25 .Los complejos de protrombinasa median la descarga o
«explosión» de trombina, un aumento súbito de su generación a
partir de protrombina, su precursor inactivo. La trombina desdobla
mediante proteólisis los fibrinopéptidos A y B de las moléculas de
fibrinógeno para generar monómeros de fibrina, que se polimeri-
zan en hebras de fibrina (es decir, el coágulo de fibrina
) 25. Por
último, el factor XIIIa, una transglutaminasa activada por la trom-
bina, entrecruza de modo covalente las hebras de fibrina para pro-
ducir un coágulo de fibrina insoluble, resistente a la degradación
fibrinolític
a 26 .Una vez más, la generación de trombina es el paso
enzimático clave que regula la hemostasi
a 27. La actividad de la
trombina no sólo media la conversión del fibrinógeno en fibrina
sino que también activa las plaquetas, convierte los cofactores V y
VIII inactivos en conformaciones activas, activa el factor XI y la
vía intrínseca de la coagulación, aumenta la expresión celular de
factor tisular, y estimula la expresión endotelial vascular de PAI-1,
regulando a la baja la actividad fibrinolític
a 17,27.
Mecanismos anticoagulantes intrínsecos
Una vez activada, la regulación de la hemostasia resulta esencial
para limitar la propagación del coágulo más allá del lugar de la
lesión. Aunque simple, un mecanismo anticoagulante importante
es la presencia del flujo sanguíneo y la hemodilución. El coágulo
plaquetario/de fibrina inicial es sumamente vulnerable a la rotura
por la tensión de cizallamiento del flujo sanguíneo. Éste limita aún
más la localización y la concentración tanto de plaquetas como de
factores de coagulación de tal modo que puede no llegar a for-
marse una masa crítica de componentes hemostático
s 25,28 .No obs-
tante, más tarde en el proceso de coagulación, se requieren
mecanismos contrarreguladores más sólidos para limitar la propa-
gación del coágulo. Se han identificado cuatro importantes vías
contrarreguladoras que parecen especialmente decisivas para
regular a la baja la hemostasia: la fibrinólisis, el TFPI, el sistema de
la proteína C y los inhibidores de la serina proteasa.
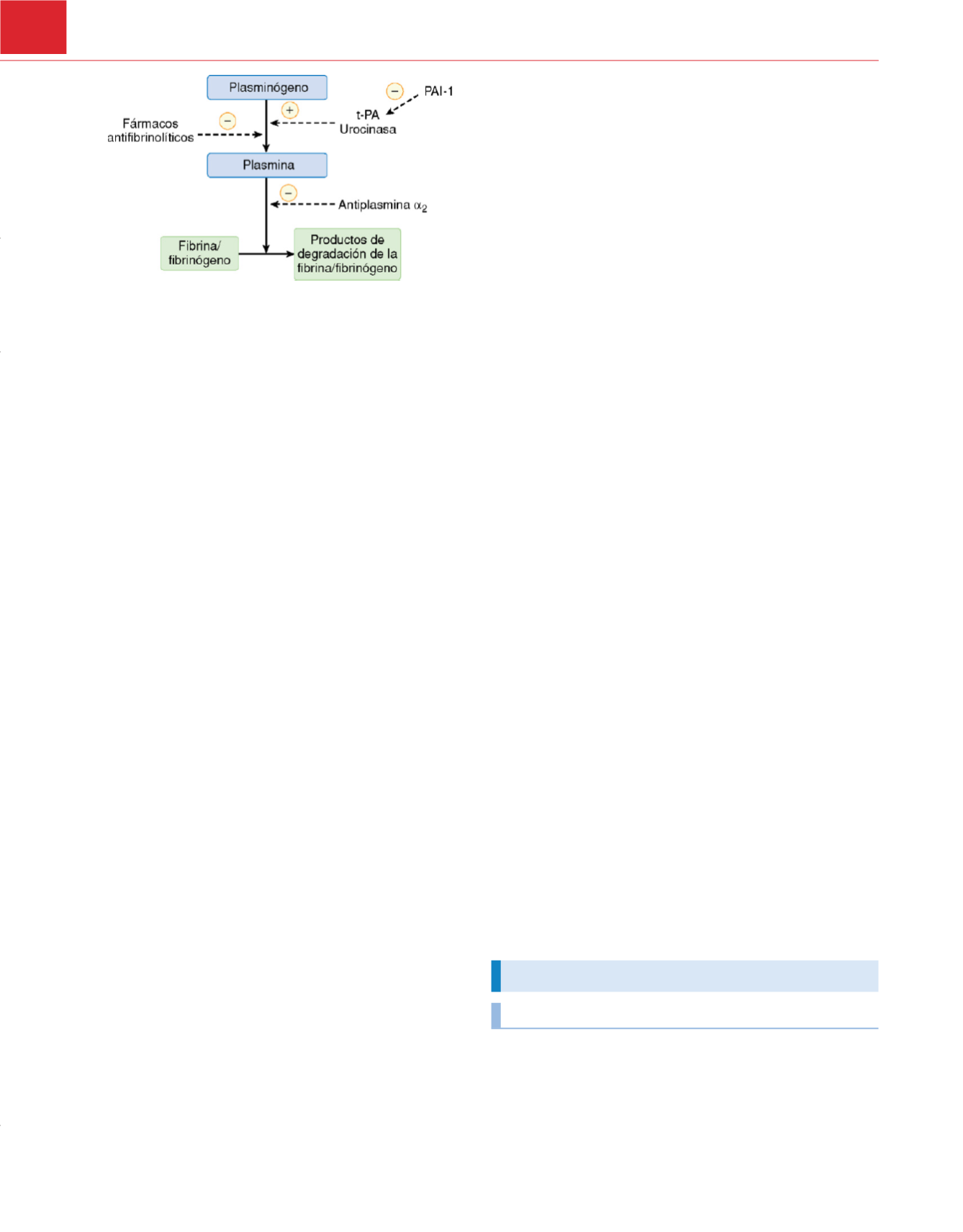
El sistema fibrinolítico comprende una cascada de reaccio-
nes de amplificación que culminan en la generación de plasmina
y la degradación proteolítica de fibrina y fibrinógeno. Al igual que
la cascada de coagulación mediada por el plasma, las proteínas
precursoras inactivas se convierten en enzimas activas, lo que
requiere un sistema equilibrado de controles reguladores para pre-
venir una hemorragia excesiva o trombosis
( fig. 46-3). El principal
mediador enzimático de la fibrinólisis, la plasmina, se genera a
partir de un precursor inactivo, el plasminógen
o 29 .In vivo, en
general, la generación de plasmina se inicia mediante la liberación
de tPA o urocinasa a partir del endotelio vascular. La trombina
proporciona un estímulo potente para la síntesis de tPA
27 .El factor
XIIa y la calicreína de la vía intrínseca activan la fibrinólisis tras la
exposición a superficies extrañas. La presencia de fibrina acelera
la generación de plasmin
a 30 .La rápida inhibición de plasmina libre
también limita la propagación de la actividad fibrinolítica. Además
de la degradación enzimática de la fibrina y fibrinógeno, la plas-
mina inhibe la hemostasia mediante la degradación de los cofac-
tores V y VIII esenciales, al igual que la reducción de los receptores
de superficie de la glucoproteína plaquetaria, esenciales para la
adhesión y la agregació
n 31 .Los productos de degradación de la
fibrina también poseen ligeras propiedades anticoagulantes.
El TFPI inhibe el complejo factor tisular/factor VIIa y, por
lo tanto, la vía extrínseca de la coagulación, que es responsable del
inicio de la hemostasia. El TFPI y el factor Xa forman complejos
unidos a los fosfolípidos de membrana que incorporan e inhiben
los complejos factor tisular/factor VII
a 3. La mayor parte de TFPI
se une al endotelio vascular pero puede liberarse a la circulación
mediante la administración de heparina. Ésta cataliza adicional-
mente la actividad inhibidora del TFP
I 32 .A medida que el TFPI
extingue rápidamente la actividad del factor tisular/VIIa, se hace
evidente el papel decisivo de la vía intrínseca en la generación
continuada de trombina y fibrina
22.
El sistema de la proteína C reviste especial importancia en
la inhibición de la hemostasia porque inhibe la trombina y a los
cofactores esenciales Va y VIIIa. La trombina inicia esta vía inhibi-
dora uniéndose a la proteína asociada a la membrana, la trombo-
modulina, para activar la proteína C
33 .Ésta, que forma un complejo
con la proteína S, un cofactor, degrada los cofactores Va y VIIIa. La
pérdida de estos cofactores decisivos limita la formación de com-
plejos de activación «tenasa» y «protrombinasa» esenciales para la
formación de factor X y trombina, respectivamente. Una vez unida
a la trombomodulina, ésta es inactivada y eliminada de la circula-
ción, lo que proporciona otro mecanismo por el que la proteína C
limita la hemostasi
a 33.
Los inhibidores serina proteasa más importantes que regulan
la hemostasia incluyen la antitrombina (AT) y el cofactor II de la
heparina. La primera se une a la trombina y a los factores IXa, Xa,
XIa y XIIa inhibiéndolos. El cofactor II de la heparina sólo inhibe
la trombina. Aunque queda por dilucidar el papel fisiológico exacto
de este último, la antitrombina desempeña un importante papel en
la inhibición de la hemostasi
a 34 .La heparina, un acelerador de los
catalizadores, se une a la antitrombina favoreciendo la inhibición de
enzimas específica
s 35 .Los glucosaminoglucanos similares al a hepa-
rina, localizados en las células endoteliales vasculares, proporcionan
lugares de inhibición para la trombina y el factor Xa in vivo.
Alteraciones de la hemostasia
Valoración de las diátesis hemorrágicas
Pocos expertos cuestionarían la importancia de valorar el riesgo
hemorrágico en el período preoperatorio; no obstante, siguen
siendo motivo de debate cuáles son los métodos apropiados para
determinar dicho riesgo. Aunque pueda resultar atractivo efectuar
preoperatoriamente pruebas de coagulación sistemáticas a todos
los pacientes que se someten a una intervención, esta estrategia
1536
Control de la anestesia
III
Figura 46-3
Principales mediadores de la fibrinólisis. Las líneas de trazo
discontinuo representan los lugares de acción de sus activadores e
inhibidores.
(De Slaughter TF: The coagulation system and cardiac surgery.
En Estafanous FG, Barash PG, Reves JG [eds.]:
Cardiac Anesthesia: Principles
and Clinical Practice,
2.
a
ed. Filadelfia, Lippincott Williams & Wilkins, 2001,
pág. 320, con autorización.)









