
Las células centrales o del intersticio mesangial son peri-
citos especializados cuyas numerosas funciones, como soporte
estructural, elaboración de la matriz y fagocitosis. Contienen
haces de actina y miosina similares a miofilamentos. La contrac-
ción mesangial, en respuesta a sustancias vasoactivas tales como
la angiotensina II, limita el flujo sanguíneo a menos asas capila-
res. Las células mesangiales regulan así la superficie glomerular
eficaz para la filtración y, en consecuencia, la permeabilidad
glomerula
r 3.
Formación del ultrafiltrado glomerular
Para cruzar la barrera de filtración entre el plasma y el líquido
tubular, una molécula debe atravesar de forma sucesiva las fenes-
traciones endoteliales, la membrana basal glomerular y el dia-
fragma de la hendidura epitelial. El endotelio capilar limita el
paso de células, mientras la membrana basal glomerular filtra las
proteínas plasmáticas. Las tres capas contienen glucoproteínas
de carga negativa, que retrasan el paso de otras proteínas de igual
carga. Por tanto, la barrera de filtración es selectiva tanto para el
tamaño como para la carg
a 1 .Las moléculas con un radio real
inferior a 1,8 nm (p. ej., agua, sodio, urea, glucosa, inulina) se
filtran libremente. Aquéllas mayores de 3,6 nm (p. ej., hemoglo-
bina, albúmina) no se filtran. La filtración de las moléculas entre
1,8 y 3,6 nm depende de su carga eléctrica. Los cationes se filtran,
pero no los aniones. En la glomerulonefritis, las glucoproteínas
con carga negativa se destruyen, se filtran las proteínas polianió-
nicas y se produce proteinuria.
La ultrafiltración glomerular está regulada por el balance de
las fuerzas de Starling que rigen el flujo de líquidos a través de la
membrana de filtració
n 4. El filtrado glomerular (FG) depende de
la permeabilidad de dicha membrana y de la diferencia neta entre
las fuerzas hidrostáticas que arrastran el líquido hacia el espacio de
Bowman y las fuerzas osmóticas que lo mantienen en el plasma:
FG = K
uf
[(P
cg
− P
eb
) − (π
cg
− π
eb
)]
donde uf =ultrafiltración, cg=capilar glomerular y eb=espacio de
Bowman.
El coeficiente de ultrafiltración K
uf
refleja la permeabilidad
capilar y la superficie glomerular. La presión arterial renal deter-
mina la presión hidrostática en el capilar glomerular (P
cg
). El
flujo plasmático arteriolar aferente determina la presión osmó-
tica plasmática (
π
cg
): un flujo sanguíneo rápido elimina molécu-
las eficaces desde el punto de vista osmótico y disminuye la
π
cg
y viceversa.
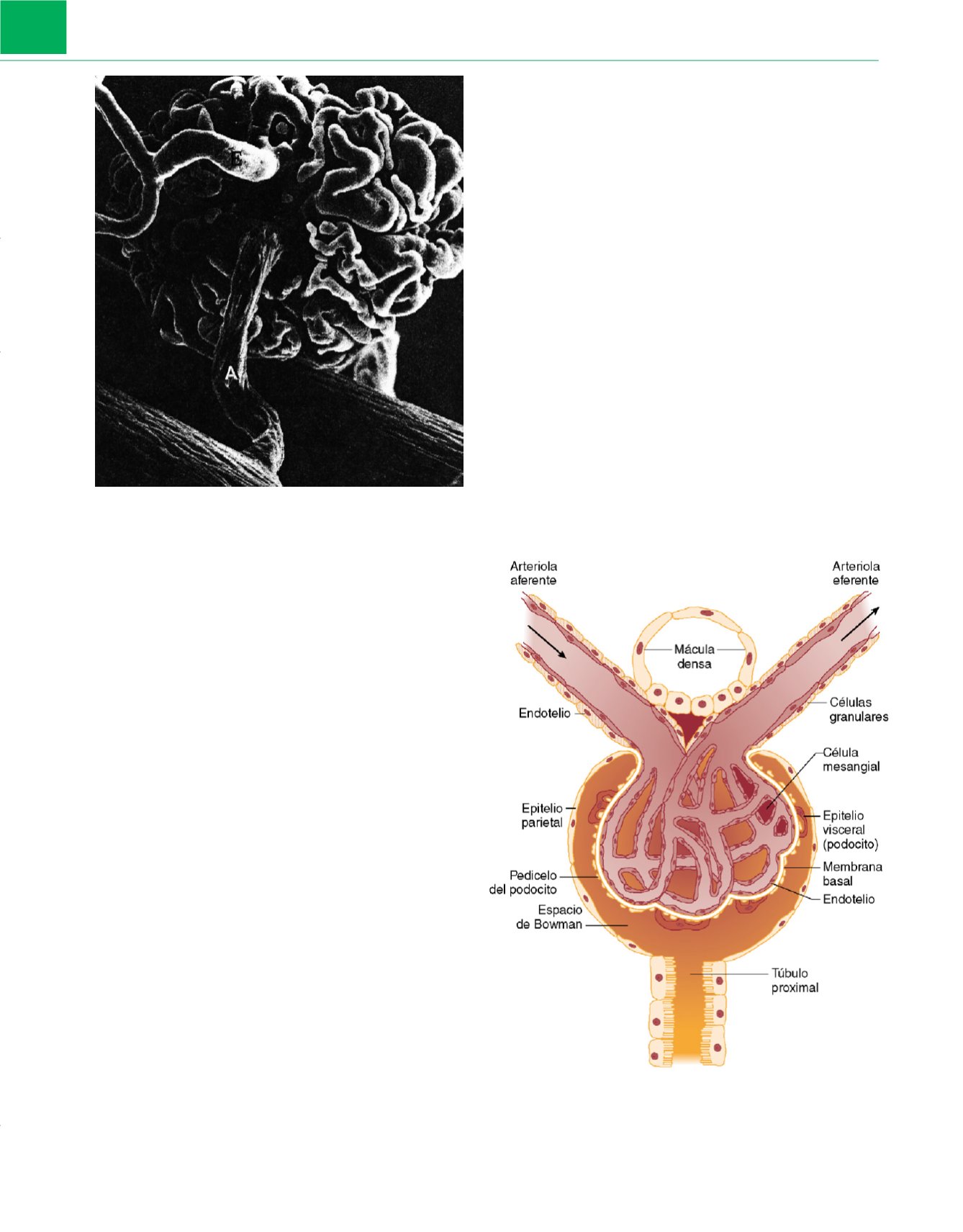
Aparato yuxtaglomerular
El aparato yuxtaglomerular integra de forma notable la estructura
y la función tubular y glomerular
( fig. 8-3 ). Una parte modificada
de la rama gruesa ascendente (la mácula densa) se adhiere al glo-
mérulo en su polo vascular, entre las arteriolas aferente y eferent
e 1.
Las células de la mácula densa son quimiorreceptores que detectan
la concentración tubular de cloruro sódico (NaCl). Los segmentos
yuxtapuestos de las arteriolas aferente y eferente contienen leio-
miocitos modificados (células granulares) que producen renina.
Las arteriolas están inervadas por fibras nerviosas simpáticas y
contienen barorreceptores que responden a los cambios de la
presión intraluminal. La renina cataliza la formación de angioten-
210
Fisiología y anestesia
I
Figura 8-3
El aparato yuxtaglomerular.
(De Stanton BA, Koeppen BM:
Elements of renal function.
En
Berne RM, Levy MN [eds.]:
Phisiology,
4.ª ed.
St. Louis, Mosby, 1998, págs. 677-698.)
Figura 8-2
Microfotografía del molde de un glomérulo sin la cápsula de
Bowman. En la parte inferior izquierda, la arteriola aferente (A) surge
de una arteriola interlobulillar y penetra en el glomérulo con sus numerosas
asas capilares. En la parte superior izquierda, la arteriola eferente (E)
abandona el glomérulo y se ramifica para formar el plexo capilar peritubular
(×300).
(De Tisher CC, Madsen KM: Anatomy of the kidney.
En
Brenner BM
[eds.]:
Brenner & Rector´s The Kidney,
6.
a
ed. Filadelfia,WB Saunders, 2000,
págs. 3-67.)









