
sensible al flujo y un quimiosensor, ambos unidos a rutas de
señales calcio-dependientes que controlan tanto la función celular
renal como la apoptosi
s 1.
Existen varios sistemas de transporte activo basados en pro-
teínas. El más destacado de ellos es el sistema sodio-potasio-ade-
nosintrifosfatasa (Na
+
-K
+
-ATPasa), situado en la membrana
basolateral. Bombea sodio fuera de la célula tubular hacia el
líquido intersticial (y la sangre capilar) en contra de gradientes
de concentración y eléctrico, a cambio de potasio al interior de
la célula tubular. El consiguiente descenso de la concentración
intracelular de sodio facilita su reabsorción pasiva desde la luz
tubular hacia la célula. El transporte de casi todos los solutos está
acoplado con el del sodio.
Los sistemas de transporte activo que mueven solutos en la
misma dirección hacia el interior o el exterior de la célula se
denominan sistemas de simporte, mientras que aquellos que los
mueven en direcciones opuestas se llaman sistemas de antiporte.
Los solutos se transportan por mecanismos activos y pasivos,
pero el agua siempre difunde de forma pasiva por un gradiente
osmótico.
Túbulo proximal
La primera porción del túbulo proximal reabsorbe casi el 100% de
la glucosa, lactato y aminoácidos filtrados, así como parte del
fosfato, mediante el acoplamiento con sistemas de simporte de
sodi
o 12 .Los iones hidrógeno se excretan hacia el túbulo por un
sistema de antiporte Na
+
/H
+
a cambio de bicarbonato. La absorción
de aniones orgánicos y de bicarbonato en la primera porción del
túbulo proximal origina una concentración distal de cloruro rela-
tivamente elevada, que favorece la entrada pasiva de este ion. En
consecuencia, el líquido tubular presenta carga positiva en relación
a la sangre, lo que favorece aún más el movimiento de sodio desde
el líquido tubular hacia la célula.
La mayoría del NaCl se absorbe de forma transcelular por
un sistema de antiporte basado en Na
+
/H
+
y cloruro de la mem-
brana celular apical. El sistema Na
+
-K
+
-ATPasa bombea sodio
hacia el espacio intersticial y un sistema de simporte K
+
/Cl
−
bombea
cloruro. El aumento resultante de la osmolalidad también arrastra
agua. En total, unos dos tercios del agua, cloruro y potasio filtrados
se reabsorben por el túbulo proximal, acoplados con la absorción
de sodio y muy influidos por ést
a 12 .214
Fisiología y anestesia
I
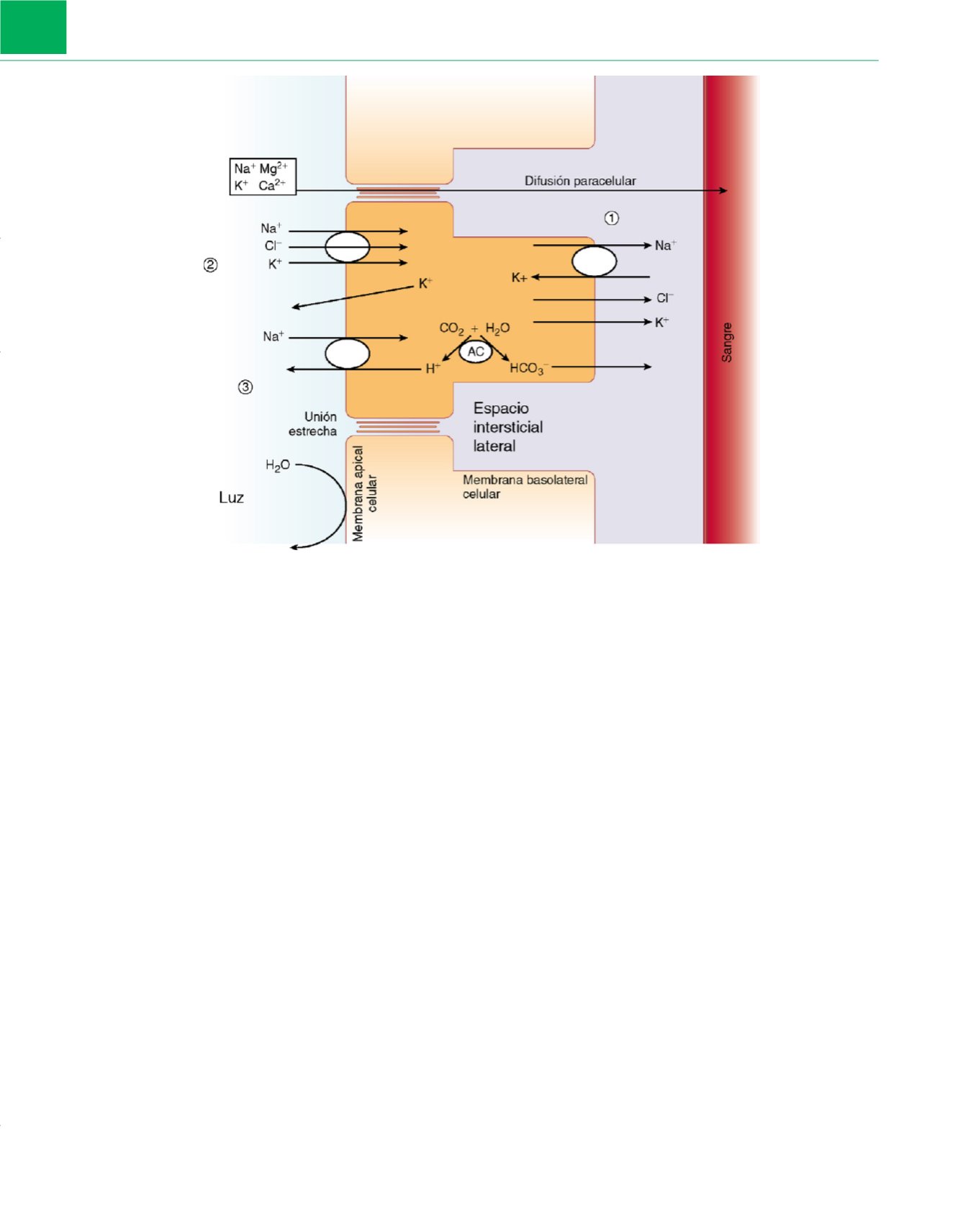
Figura 8-8
Mecanismos de secreción y reabsorción tubulares. Esta célula tubular del asa gruesa ascendente de Henle reúne los principales mecanismos
de secreción y reabsorción, uno o más de los cuales son utilizados por varios segmentos del túbulo. El mecanismo de transporte más ubicuo y relevante
es la bomba Na
+
-K
+
-ATPasa de la membrana basolateral celular (1), que requiere energía y bombea sodio al intersticio exterior en contra de su gradiente
de concentración y mantiene una concentración intracelular baja. Este mecanismo favorece la entrada de sodio de la luz tubular, facilitada por un sistema de
simporte de cloruro sódico en la membrana apical celular (2), lo que crea suficiente energía potencial para arrastrar potasio al interior en contra de su
gradiente de concentración y es el punto de inhibición principal de los diuréticos de asa. Un sistema de antiporte Na-H
+
en la membrana apical celular
(3) ayuda a la reabsorción de sodio y a expulsar H
+
y favorece así la reacción del agua con el dióxido de carbono para formar H
+
e ion bicarbonato, bajo la
influencia de la anhidrasa carbónica (AC). El bicarbonato sale por difusión al capilar. La reabsorción de sodio está, por tanto, acoplada a la pérdida de H
+
y a la reabsorción de bicarbonato (HCO
−
3
). Las proteínas transportadoras crean una carga positiva en la luz, que arrastra a iones como el sodio, calcio,
potasio y magnesio de forma pasiva a través de las uniones estrechas por difusión paracelular. El asa gruesa ascendente de Henle presenta una elevada
impermeabilidad exclusiva al agua, de forma que la osmolalidad luminal se reduce de manera progresiva a menos de 150mOsm/kg (el «segmento
dilutor»).
(Modificada de Stanton BA, Koeppen BM: Elements of renal function.
En
Berne RM, Levy MN [eds.]:
Phisiology,
4.
a
ed. St. Louis, Mosby, 1998,
págs. 677-698.)









