
longitudinal y circunferencial de los anestésicos locales más amplia,
y 3) y una duración de acción más corta por la disminución de la
liberación secundaria desde sus puntos de unión locales.
Distribución regional hasta la zona diana
Los anestésicos locales fijan su diana de acción en los canales de
Na
+
dependientes de voltaje en el interior de las fibras nerviosas.
Las moléculas no ionizadas son las únicas que pueden atravesar las
membranas biológicas y la velocidad de dicho proceso depende del
número y el grosor de las vainas (que aumenta con la edad).
Absorción sistémica y distribución
U
nión a
proteínas
plasmáticas
.
Los anestésicos locales,
en su forma no ionizada, cruzan casi sin problemas el endotelio de
los capilares que rodean la zona de inyección. Como el gasto car-
díaco y el flujo sanguíneo local de los lactantes es entre dos y tres
veces mayor que en los adultos, la absorción de los anestésicos
locales hacia la circulación sistémica aumenta en conformidad, y
los fármacos vasoactivos, como la epinefrina, ralentizan con suma
eficacia la absorción sistémica.
Una vez que han accedido al interior del lecho vascular, los
anestésicos locales se unen a proteínas plasmáticas, y principal-
mente a la albúmina sérica (ASH) y a la glucoproteína
a
1
-ácida
(AAG), u orosomucoide. La ASHmuestra una afinidad baja por los
anestésicos locales y numerosas sustancias farmacológicas pueden
competir por los lugares de unión disponibles. Además, las concen-
traciones plasmáticas de ASH son bajas durante los primeros meses
de vida, especialmente en los lactantes prematuros y en ayunas; así
pues, la protección ofrecida por la ASH contra la toxicidad sisté-
mica de los anestésicos locales es baja y disminuye en el período
postoperatorio. La afinidad de la AAG por los anestésicos locales
es entre 5.000-10.000 veces mayor que la de la ASH, lo que la con-
vierte en una proteína sumamente eficaz para proteger al paciente
contra la toxicidad sistémica (la cual depende de la fracción libre
de los anestésicos locales no unida a las proteínas). Sin embargo,
también la concentración plasmática de AAG es muy baja al nacer
(0,2-0,3 g/l) y no alcanza los valores del adulto (0,7-1,0 g/l) antes
del primer año de vid
a 11-13.
Como la concentración plasmática de las dos proteínas
capaces de unirse a los anestésicos locales es baja en el momento
de nacer, la fracción libre de todos los anestésicos locales está
aumentada en los lactantes; por tanto, deben reducirse notable-
mente las dosis máximas de todas las aminoamidas, aunque la
concentración plasmática de AAG aumenta en el período postope-
ratorio, salvo en el caso de la insuficiencia hepátic
a 13 .A
lmacenamiento
en
los
eritrocitos
.
Los anestésicos
locales, una vez dentro del torrente sanguíneo, se distribuyen en los
eritrocitos, que retienen del 20-30% de la dosis total, según el anes-
tésico y el hematocrito. El almacenamiento en los eritrocitos suele
tener un impacto poco relevante sobre la farmacocinética de los
anestésicos locales, salvo:
•
En los recién nacidos: los valores de hematocrito altos (que
pueden superar el 70%) y el aumento de tamaño de los
mismos (macrocitosis fisiológica) provocan un «atrapa-
miento» de los anestésicos locales, disminuyendo de este
modo los valores de Cmax después de una inyección única,
pero con un incremento en la liberación secundaria,
aumentando de este modo la semivida de todos los anesté-
sicos locales.
•
En los lactantes: la anemia fisiológica disminuye el almace-
namiento en los eritrocitos y su efecto protector contra la
toxicidad sistémica de los anestésicos locales (únicamente
después de una inyección única) al saturarse los lugares de
unión a las proteínas plasmáticas, es decir, cerca de las con-
centraciones sanguíneas tóxicas.
A
bsorción
desde
el
espacio
epidural
.
La absorción en
el espacio epidural está bastante bien estudiada. La cinética de
absorción es la misma en los niños y en los lactantes, pero cuanto
más pequeño sea el paciente menos acentuada es la configuración
bifásica de la curva de concentración plasmática. La concentración
plasmática máxima y la pendiente de disminución de la curva de
concentración están aumentada
s 14,15, mientras que el tiempo
(Tmax) hasta alcanzar la concentración plasmática máxima (Cmax)
permanece básicamente invariable; por ejemplo, el Tmax de la
bupivacaína es aproximadamente de 30 minutos, independiente-
mente de la edad del paciente.
La ropivacaína es una excepción notable. La Tmax puede
prolongarse en los lactantes hasta 2 horas tras la inyección epidu-
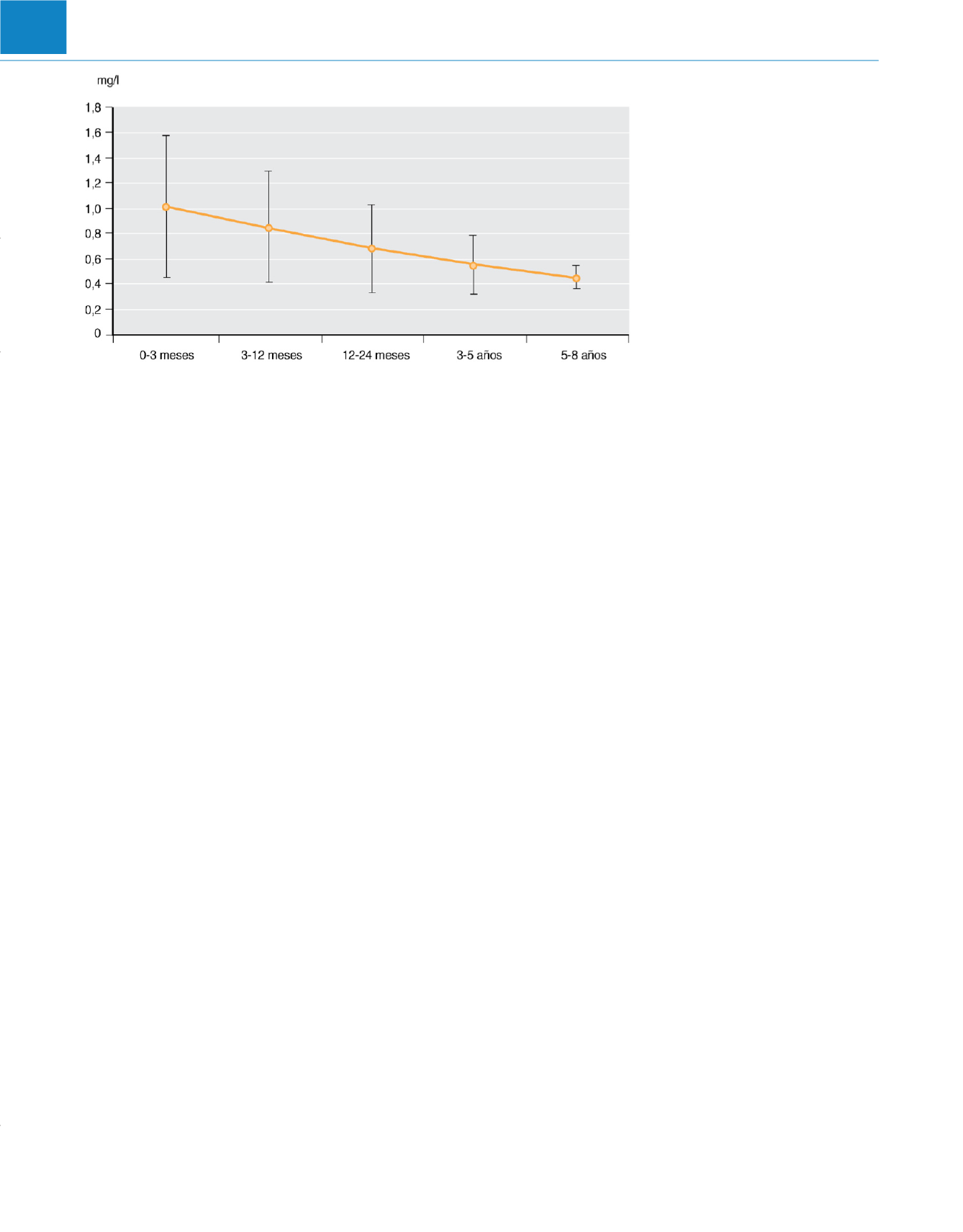
ral caudal o lumbar, y la Cmax también está aumentada
( fig. 71-2 ) 16 .Este perfil farmacocinético inusual resulta difícil de comprender;
se han planteado algunas hipótesis tentadoras, como inmadurez
enzimática, captación sistémica más lenta y disminución del
volumen de distribució
n 17,18 .Las propiedades vasoconstrictoras
intrínsecas de la ropivacaína también pueden desempeñar el
mismo papel que se manifiesta al añadir epinefrina. De cualquier
forma, este incremento en los valores de Cmax y Tmax no puede
pasarse por alto, ya que muchas intervenciones quirúrgicas en los
lactantes son breves y por el hecho de que los niños pueden aban-
2288
Anestesia pediátrica
V
Figura 71-2
Valores de Cmax de la
ropivacaína después de una inyección caudal
de 2mg/kg en grupos de edad diferentes.









