
La suma de estas frecuencias es 1.
Además del PNU existen otros tipos de variantes genéticas
como inserciones y deleciones, en las que faltan o se añaden frag-
mentos de ADN genómico, y repeticiones microsatélites, en las que
se repiten varios nucleótidos (p. ej., repetición de dinucleótido
GCGCGCGC [
n
= 4 repeticiones GC] o repeticiones trinucleóti
doTACTACTACTACTACTAC [
n
=6 repeticiones TAC].El número
de repeticiones en un microsatélite se correlaciona con algunas
enfermedades y puede usarse en análisis de genoma completo para
identificar regiones cromosómicas relacionadas con enfermedad.
Los cambios catastróficos en el ADN consisten a menudo en
deleciones o inserciones de ADN en la región codificadora que no
son múltiplos de tres. Estos cambios producen un cambio estruc-
tural en la secuencia de triplete de nucleótidos usada para codificar
aminoácidos en las proteínas, con probabilidad de que sea una
proteína finalizadora. Los PNU que cambian y codifican aminoá-
cidos para detener un codon pueden ser también catastróficos
porque pueden dar lugar a una proteína truncada.
No todas las variantes genéticas tienen consecuencias bioló-
gicas. Igual que las diferencias en el color de los ojos o en la huella
dactilar no tienen consecuencias para la salud, numerosas variantes
genéticas producen diversidad «de fondo» sin consecuencias bio-
lógicas manifiestas. De hecho, las variantes genéticas con efectos
biológicos o médicos son una minoría de todas las variantes gené-
ticas que sabemos que existen. La suma total de diversidad genética
(con y sin implicaciones biológicas) produce una huella genética única, un hecho utilizado en medicina forense para identificar
a una persona o a sus familiares (o a ambos).
No resulta sencillo identificar una asociación entre variantes
genéticas y enfermedad, tratamiento farmacológico o evolución del
paciente, y en condiciones ideales precisa la ayuda de un experto
en genética estadística. En los estudios farmacogenéticos hay que
prestar atención especial a las covariantes clínicas e incluso a la
estructura de la subpoblación genética (definida vagamente como
diversidad genética debida a movimiento de la población global).
Según el número de genes analizados, el análisis estadístico de la
asociación va desde análisis simples e inmediatos (la prueba de
la chi al cuadrado para comprobar si una variante o haplotipo [un
grupo de PNU] es más frecuente en una población diana) a análisis
más complicados (modelos compuestos, pruebas de permutación,
prueba secuencial prospectiva, etc.). En los estudios de asociación
clínica es importante asegurarse de que los criterios de valora
ción clínicos son reproducibles, y lo ideal es que incluyan criterios
de valoración intermedios, como concentraciones de proteínas o
actividad enzimática. Conforme vayamos conociendo más variantes
genéticas humanas relevantes, nuestros conocimientos sobre la
implicación de la genética en la respuesta a los fármacos y en
la evolución del paciente aumentarán de modo notable.
Diversidad genética en farmacocinética
Las variantes genéticas de origen natural pueden influir en la acti-
vidad de enzimas responsables del metabolismo del fármaco, alte-
rando con frecuencia un aminoácido clave en o cerca del sitio de
acción enzimática. En términos prácticos, esta diversidad enzimá-
tica es pocas veces evidente en ausencia de tratamiento farmaco-
lógico. En presencia de tratamiento farmacológico, la diversidad
274
Farmacología y anestesia
II
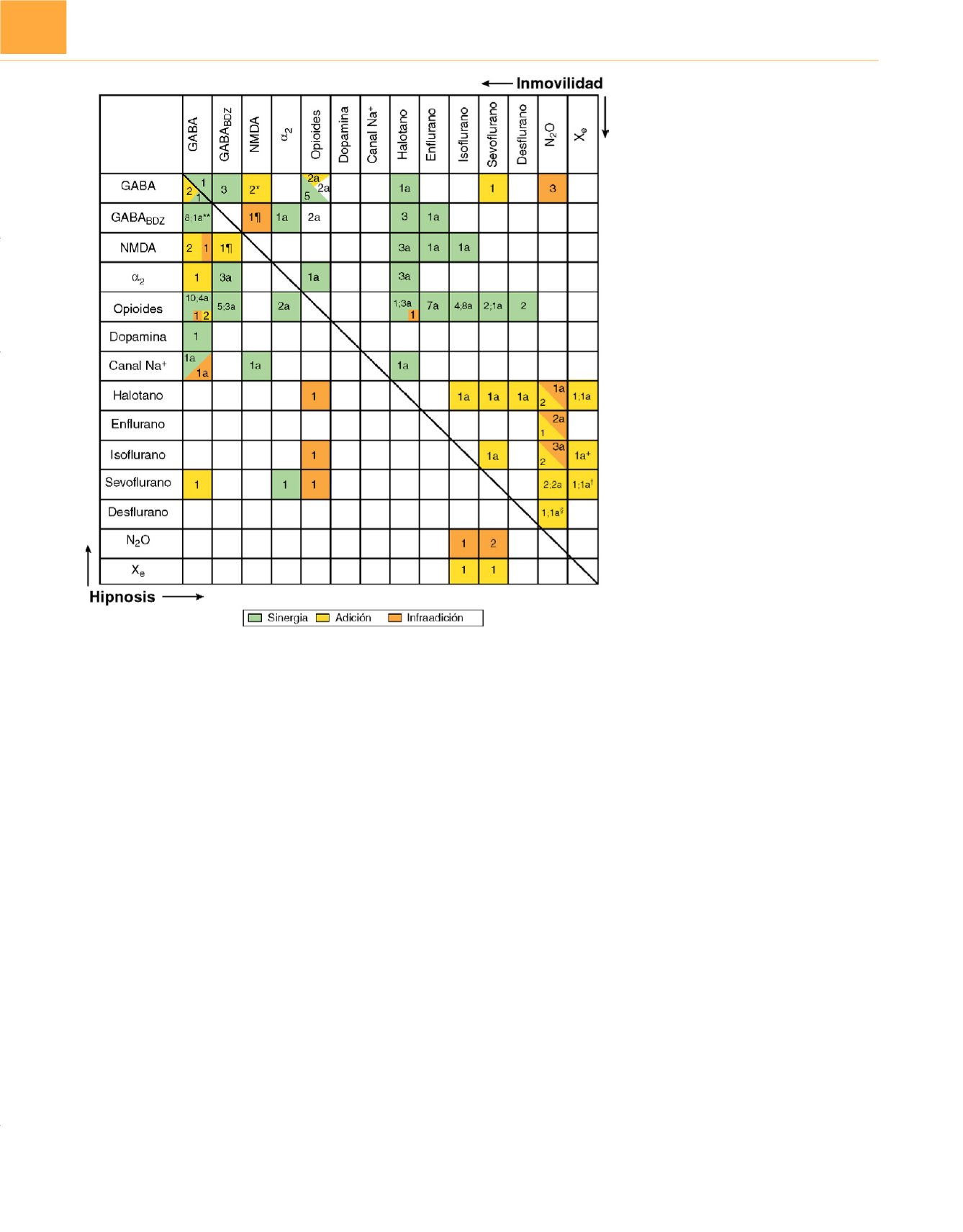
Figura 9-39
Resumen de interacciones
farmacológicas en el ser humano y en animales
para la hipnosis (pérdida de conciencia en el ser
humano, pérdida del reflejo de incorporación en
animales) y la inmovilidad (ausencia de respuesta
de movimiento a la estimulación dolorosa). Los
números de cada celda indican el número de
artículos que avalan el dato. Ácido
g
-aminobutírico (GABA)=propofol, metohexital,
etomidato; GABA
BDZ
=midazolam, diazepam;
N
-metil-
d
-aspartato (NMDA)=ketamina;
a
2
=demedetomidina, clonidina; opioide=morfina,
alfentanilo, fentanilo, sufentanilo, remifentanilo;
dopamina=droperidol, metoclopramida; canal
Na
+
= lidocaína, bupivacaína. (
De Hendirckx JFA,
Eger EI, Sonner JM, Shafer SL: Is synergy the rule?
A review of anesthetic interactions producing
hipnosis and immobility.
Anesth Analg
107:
494-506, 2008.
)









