
tambiénlainteracciónentrepropofolyalfentaniloenlarecuperación
del nivel de consciencia, como se muestra en la
figura 9-38. Como
se expone en el capítulo 18, estudios como éste aportan el funda-
mento para la selección racional de opioides y para diseñar pautas
óptimas de infusión de opioides.
Hendrickx y cols
21 .han analizado recientemente la inte-
racción de los fármacos anestésicos que afectan a la nocicep-
ción, analgesia e hipnosis. Examinaron dos criterios de
valoración: «hipnosis» definida como una pérdida de conciencia
en el ser humano y como pérdida del reflejo de incorporación
en los animales, y la «inmovilidad» definida como la pérdida de
respuesta de movimiento ante un estímulo nocivo en una
persona no paralizad
a 21. Como se aprecia en la
figura 9-39, la
interacción entre parejas de fármacos intravenosos y entre fár-
macos intravenosos y anestésicos inhalados es habitualmente
sinérgica. La excepción son los antagonistas del
N
-metil-d-
aspartato (NMDA), ketamina y óxido nitroso, que presentan
sinergia, adición o infraadición en distintos modelos. Por el
contrario, los anestésicos inhalados son estrictamente aditivos
en sus interacciones con otros anestésicos inhalados, lo que
indica un mecanismo de acción común.
Los estudios clásicos de interacción, como los señalados
anteriormente, examinan las concentraciones asociadas a una res-
puesta particular (como una probabilidad de movimiento del
50%) a dos fármacos evaluados por separado y en combinación.
Sin embargo, una visión más general es que cualquier combina-
ción de dos fármacos está asociada a una respuesta. Esto se aprecia
mejor mediante la «superficie de respuesta» en la que los ejes
x
e
y
de la superficie son concentraciones (o dosis) de los fármacos
A y B, y el eje
z
es la respuesta a dicha combinación particular.
Minto y col
s 22 .propusieron un modelo matemático para las
superficies de respuesta de una variedad de superficies de interac-
ción de interés para el anestesiólogo. La
figura 9-40muestra seis
ejemplos de superficies de respuesta posibles en función de la
naturaleza de la interacción.
Diversidad en la respuesta
al fármaco
Los anestesiólogos observan variaciones individuales en la res-
puesta clínica a los fármacos utilizados todos los días. Esta diver-
sidad puede ser consecuencia de diferencias en procesos
farmacocinéticos como absorción, distribución, metabolismo y
excreción del fármaco. La diversidad individual puede estar causada
también por diferencias farmacodinámicas, como las diferencias
intrínsecas en la sensibilidad del receptor, aumento o disminución
de la expresión y alteraciones en otras dianas que alteran la acción
del fármaco. La
figura 9-35muestra la relación entre diversidad del
paciente y una curva dosis-respuesta típica. Las causas de diversi-
dad farmacocinética y farmacodinámica son genéticas, fisiológicas
e interacciones farmacológicas.
Farmacogenética
El campo de la farmacología que describe los efectos de la diver-
sidad genética en la acción del fármaco se denomina
farmacoge-
nética
. La farmacogenética se refiere a la diversidad genética en
la absorción, metabolismo y distribución de fármacos en el orga-
nismo (diversidad farmacocinética innata) o en la respuesta del
organismo al fármaco, como la que podría estar causada por
diferencias en la estructura del receptor o en la fisiología del
paciente (diversidad farmacodinámica innata). Para comprender
el efecto de la diversidad genética en la farmacocinética y farma-
codinámica es importante definir antes las variantes genéticas o
polimorfismos.
Polimorfismo genético
se refiere a cualquier tipo de varia-
ción en un gen. Para describir cada tipo específico de variante
genética se emplea un lenguaje más preciso. Cuando se intercam-
bia un nucleótido por otro, la variante resultante se denomina
polimorfismo de nucleótido único
(PNU). El nucleótido sustituido
menos frecuente se define como alelo menor mientras que el
nucleótido de «tipo natural» más frecuente se define como alelo
mayor. La mayoría de los PNU son bialélicos, con tan sólo dos
nucleótidos posibles, el alelo mayor y el menor. En casos excep-
cionales, el PNU puede ser trialélico, con dos alelos menores posi-
bles y tres nucleótidos totales posibles. Con cuatro nucleótidos
posibles en el ADN, es teóricamente posible tener representados
cada uno de los cuatro nucleótidos, pero esto no sucede casi
nunca. Limitamos nuestra exposición a los PNU bialélicos porque
son los más frecuentes.
La frecuencia de alelo se refiere a la frecuencia del alelo
menor, denominada
f
(-). Por tanto, la frecuencia de alelo mayor es
1-
f
(-). Dado que se trata del alelo menor,
f
(-) es por definición
menor de 0,5. Como las personas tienen dos copias de cada alelo,
existen tres combinaciones posibles de PNU bialélico: AA, Aa y aa,
en las que A designa el alelo mayor y a el alelo menor. La ecuación
de Hardy-Weinberg proporciona la frecuencia de cada una de estas
combinaciones según la premisa generalmente correcta de que el
emparejamiento de alelos es aleatorio:
aa (homocigótico para alelo menor):
f
(-)
2
AA (homocigótico para alelo mayor): (1-
f
[
-
])
2
Aa (heterocigótico): 2
f
(-) (1-
f
[-])
Principios básicos de farmacología
273
9
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
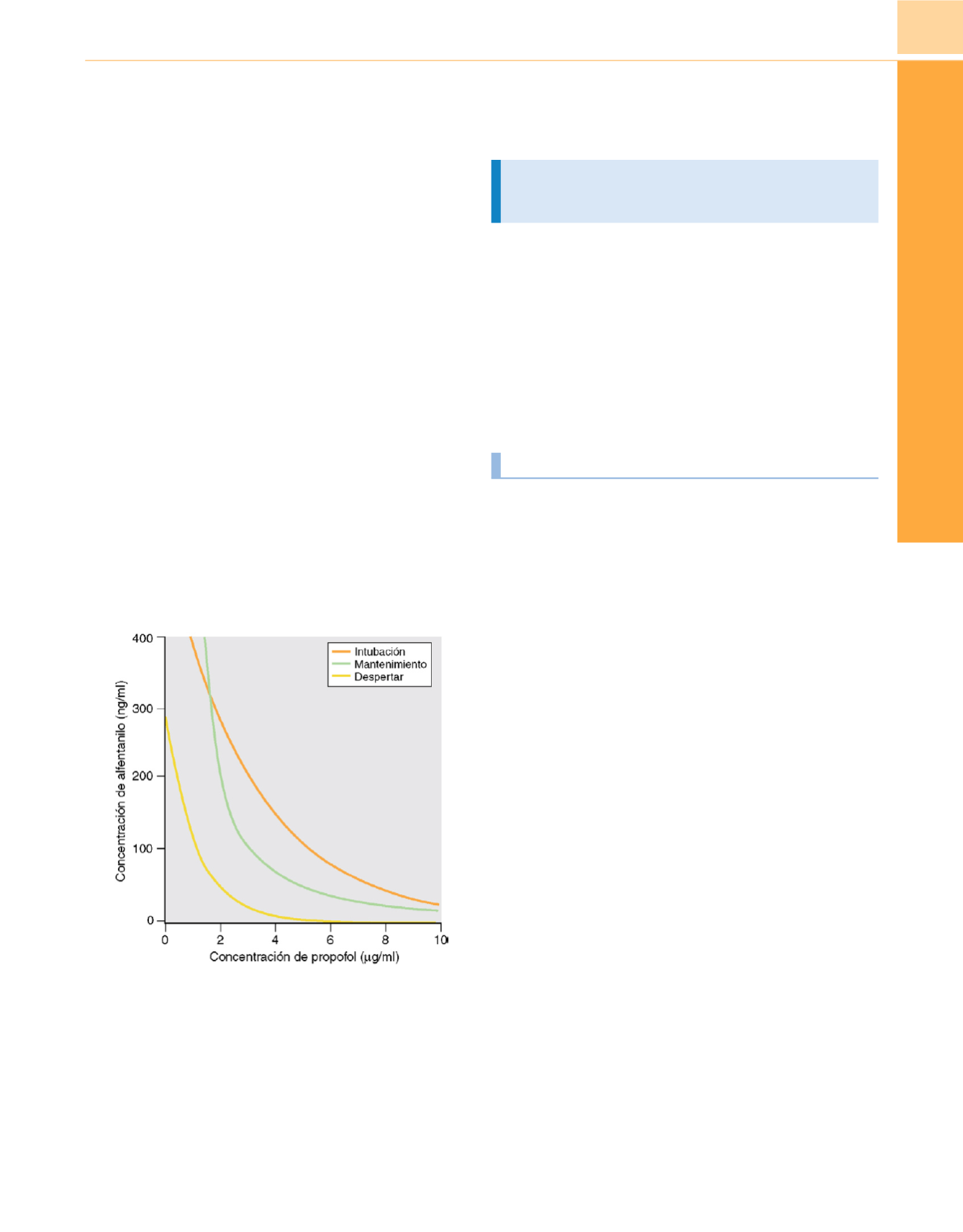
Figura 9-38
Influencia del alfentanilo en la concentración de propofol
asociada a una probabilidad del 50% de respuesta a la incisión e intubación,
así como a una probabilidad del 50% de despertar al final de la cirugía. Una
cantidad moderada de alfentanilo reduce mucho la dosis de propofol
necesaria para eliminar la respuesta al estímulo doloroso. No obstante, por
debajo de una concentración de propofol de 2
m
g/ml, incluso dosis altas de
alfentanilo no pueden eliminar de forma fiable la respuesta a estímulos
dolorosos. (
Adaptada de Vuyk J, Lim T, Engbers FH y cols.: The
pharmacodynamic interaction of propofol and alfenatnil during lower
abdominal surgery in women.
Anesthesiology
83:8-22, 1995.
)









