
El sistema nervioso autónomo
43
2
Sección I
Fisiología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
identificado hasta 20 subunidades
a
diferentes. La estructura de la
a
-subunidad unida determina la función de la proteína G. Se dis-
tinguen cuatro categorías de subunidades
a
:
a
s
,
a
i
,
a
q
y
a
12
. Los
correspondientes complejos de proteínas G formados cuando las
subunidades
a
se unen a la estructura
bg
se denominan G
s
, G
i
, G
q
y G
o 55 .Cada clase de receptor adrenérgico se acopla a una de las
subfamilias principales de proteínas G, unidas a diferentes efecto-
res. Los principales subtipos de receptores
a
1
,
a
2
y
b
se unen a G
q
,
G
i
, y G
s
, respectivamente, que están vinculados a la activación de
la fosfolipasa C (
a
1
), la inhibición de la adenilil ciclasa (
a
2
,) o la
estimulación de esta misma enzima (
b
) (v.
fig. 2-10). En su estado
de reposo, la proteína G está unida al guanosindifosfato (GDP) y
no está en contacto con el receptor. Cuando el receptor es activado
por el primer mensajero, estimula a la proteína G para que libere
GDP y une el guanosintrifosfato (GTP) a su subunidad
a
, activán-
dose a sí mismo. El GTP unido señala a la proteína G para que se
divida en dos partes, constituidas por la estructura
a
-GTP y la
subunidad
bg
. La subunidad
a
liberada se fija al efector, recupe-
rando su estado de reposo. Dicha subunidad
a
se une a la unidad
bg
y la proteína G reconstruida queda de nuevo en espera en la
cara interna de la membrana.
La estimulación del
b
-receptor por parte de la proteína G
potencia la actividad de la adenilato ciclasa y la formación de
AMPc. El más breve contacto entre los receptores
b
-adrenérgicos
de la membrana plasmática y la adrenalina o la noradrenalina da
lugar a importantes aumentos (de hasta 400 veces el valor basal en
pocos minutos) de los niveles intracelulares de AMPc. El incre-
mento de la síntesis de AMPc activa las proteía cinasas, que fosfo-
rilan determinadas proteínas diana, desencadenando diversas
respuestas celulares que completan la vía entre el receptor y el
efecto. La estimulación de los
a
2
-receptores da lugar a la inhibición
G
i
de la adenilato ciclasa. Por otra parte, la relativa abundancia de
proteínas G determina la amplificación del agonismo receptor en
la fase de transducción de señal. El número de moléculas de pro-
teínas G excede el receptores
b
-adrenérgicos y moléculas de ade-
nilato ciclasa. Son la concentración de receptores y, en último
término, la actividad de la adenilato ciclasa los que limitan la res-
puesta a las catecolaminas, lo que tal vez explica la eficacia de los
inhibidores de la fosfodiesteras
a 56,57.
Las células del miocardio responden a la estimulación de
receptores de manera diferente, según la identidad del primer men-
sajero. Dos efectos opuestos, inhibición y estimulación de la con-
tractilidad, son ambos generados por la secuencia receptor
→
proteína G
→
efector
→
cascada enzimática. No obstante, la iden-
tidad de los agentes químicos de la secuencia es diferent
e 58. La
noradrenalina hace que las células miocárdicas se contraigan con
más intensidad cuando la subunidad
a
de la proteína estimuladora
(G
s
) activa la adenilato ciclasa. Las subunidades
a
de esta proteína
hacen que los canales del potasio se abran, permitiendo el flujo de
salida de este ion. La fuerza de contracción disminuye cuando la
acetilcolina actúa como primer mensajero y estimula a su receptor
para activar las proteínas inhibidoras G
i
o G
o
. Desde el punto
de vista clínico, es importante el hecho de que los cambios
segundo a segundo de la frecuencia cardíaca puedan explicarse
por la activación simultánea de G
s
y G
o
. La corriente inducida por
G
o
es mayor que la de G
s
, lo que explica la impresión de que la
estimulación vagal del corazón predomine en presencia de estimu-
lación simpática, como puede suceder en pacientes no medicados
previament
e 58 .Regulación al alza y regulación a la baja
Los receptores
b
-adrenérgicos cambian su repuesta dinámica en
función de la cantidad de noradrenalina presente en la hendidura
sináptica o el plasma. Para ellos, esta respuesta es rápida: a los
30 minutos de la denervación o el bloqueo adrenérgico el número
de receptores aumenta. Esta regulación al alza explica por qué la
interrupción repentina del tratamiento con fármacos bloqueantes
de los receptores
b
-adrenérgicos produce taquicardia de rebote y
hace aumentar la incidencia de IM e isquemia. Numerosos fenó-
menos crónicos, como las venas varicosa
s 59o el envejecimiento,
pueden reducir el número de receptores adrenérgicos o la sensibi-
lidad sistémica.
Clínicamente y a nivel celular, las respuestas a numerosas
hormonas y neurotransmisores se desvanecen con rapidez, a pesar
de la continua exposición a agonistas adrenérgico
s 60 .Este fenó-
meno, denominado desensibilización, ha sido especialmente estu-
diado en relación con la estimulación de los niveles de AMPc por
parte de los receptores
b
-adrenérgicos de la membrana plasmática.
Los mecanismos para él postulados incluyen desacoplamiento
(p. ej., por fosforilación), secuestro y regulación a la baja. Los pro-
cesos moleculares subyacentes a la desensibilización rápida de los
receptores no parecen requerir la internalización de dichos recep-
tores, sino más bien una alteración en su funcionamiento que los
desacople de la estimulación de la proteína G
s
. La desensibilización
inducida por agonistas implica la fosforilación de los receptores
acoplados a proteínas G por acción de dos clases de serina-treonina
cinasas. Una de dichas clases inicia la desensibilización específica
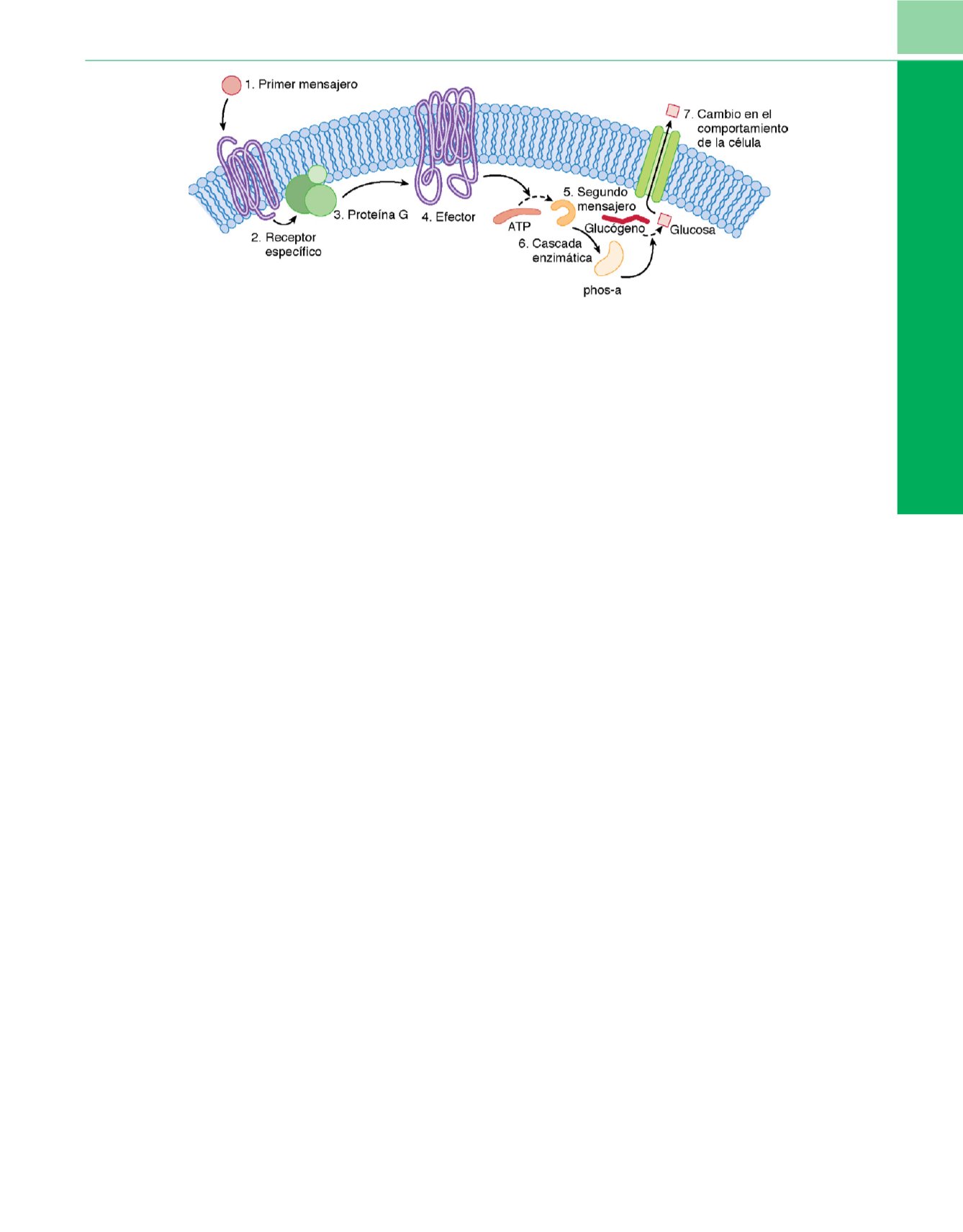
Figura 2-13
La glucogenólisis activada por adrenalina en una célula hepática pone de manifiesto el papel de las proteínas G en la función celular. El primer
mensajero (adrenalina) se une a su receptor específico, estimulando la producción de proteínas G (en este caso G
s
) para activar el efector, la adenilil ciclasa.
Esta enzima convierte el adenosintrifosfato (ATP) en adenosinmonofosfato cíclico (AMPc), el segundo mensajero, desencadenante de una cascada de
reacciones enzimáticas que estimula a la enzima fosforilasa (phos-a) para que el glucógeno se convierta en glucosa, que es expulsada por la célula.
(
De Linder ME, Gilman AG: G Proteins
. Sci Am
267:56, 1992.
)









