
46
Fisiología y anestesia
I
Los receptores purinérgicos se diferencian en P
1
y P
2
. Los P
1
se unen a la adenosina, mientras que los P
2
lo hacen al ATP. Se han
identificado cuatro subtipos de receptores P
1
(A
1
, A
2A
, A
2B
y A
3
).
Todos los receptores P
1
se acoplan a proteínas G de membrana.
Existen dos subclases de receptores P
2
(P2X y P2Y). Los P2X se unen
al ATP y abren los canales iónicos regulados por ligandos. Por el
contrario, los receptores P2Y se unen a proteínas G y a sus sistemas
segundos mensajeros asociados. Se han identificado hasta siete sub-
tipos P2X (P2X
1-7
) y ocho subtipos P2Y (P2Y
1,2,4,6,11,12,13,14
). Algunos
receptores P2Y son preferentemente activados por adenosindifos-
fato en vez de por ATP, y otros son activados por nucleósidos piri-
midínicos (uridintrifosfato), así como por agonistas purinérgicos.
El ATP liberado por las terminaciones nerviosas en un con-
texto de hipertensión genera significativas disminuciones de la presión
arterial. El ATP unido a MgCl
2
es un potente vasodilatador pulmonar
utilizado para tratar a pacientes con hipertensión pulmonar secunda-
ria a cardiopatía congénita. Además, se emplea en el tratamiento de
la lesión renal postisquémica. La cotransmisión purinérgica también
se produce en el tracto gastrointestinal, donde la estimulación de
receptores de ATP (y de NO) inhibe el peristaltismo.
Los neuromoduladores modifican el proceso de neurotrans-
misión. Pueden ser neurohormonas circulantes, agentes locales o
sustancias neurotransmisoras liberadas por los mismos nervios
o por otros próximos. La neuromodulación se produce presinápti-
camente, disminuyendo o aumentando la cantidad de neuro
transmisor liberada durante la transmisión, o postsinápticamente,
alterando el alcance o la duración del efecto del neurotransmisor.
En todos los ejemplos conocidos en los que se produce neuromo-
dulación pre o postsináptica, estas sustancias actúan de forma con-
certada para atenuar o incrementar la transmisión efectiva. El
fundamento de sus efectos puede reflejar la geometría variable de
la unión neuroefectora autonómic
a 76,77. A diferencia de la unión
neuromuscular, la unión neuroefectora autonómica presenta un
estado dinámico y exhibe sólo una escasa especialización postsi-
náptica. Las aminas biogénicas con frecuencia deben atravesar
importantes distancias. Dada la breve semivida de estas sustancias,
la neuromodulación aporta un mecanismo biológico destinado a
intensificar y prolongar su acció
n 78.
El NPY también está colocalizado con la noradrenalina y el
ATP. Sin embargo, en ciertos vasos, el NPY ejerce una acción escasa
o nula. Actúa en cambio como neuromodulador presináptico para
inhibir la liberación de noradrenalina por parte del nervio o post-
sinápticamente para potenciar su acción (v.
fig. 2-14 A ) 79,80. En otros
vasos, sobre todo en los de bazo, músculo esquelético y vasculatura
cerebral y coronaria, el NPY ejerce un efecto vasoconstrictor
directo. En el corazón y el cerebro, neuronas intrínsecas locales
(no simpáticas) utilizan el NPY como transmisor principal
(v.
fig. 2-14 B). En el bazo, el NPY parece actuar como contransmi-
sor genuino de la noradrenalina en los nervios simpáticos perivas-
culares (v.
fig. 2-14C
) 81. La frecuencia de la estimulación determina
qué vasos se movilizan para liberar sus transmisores.
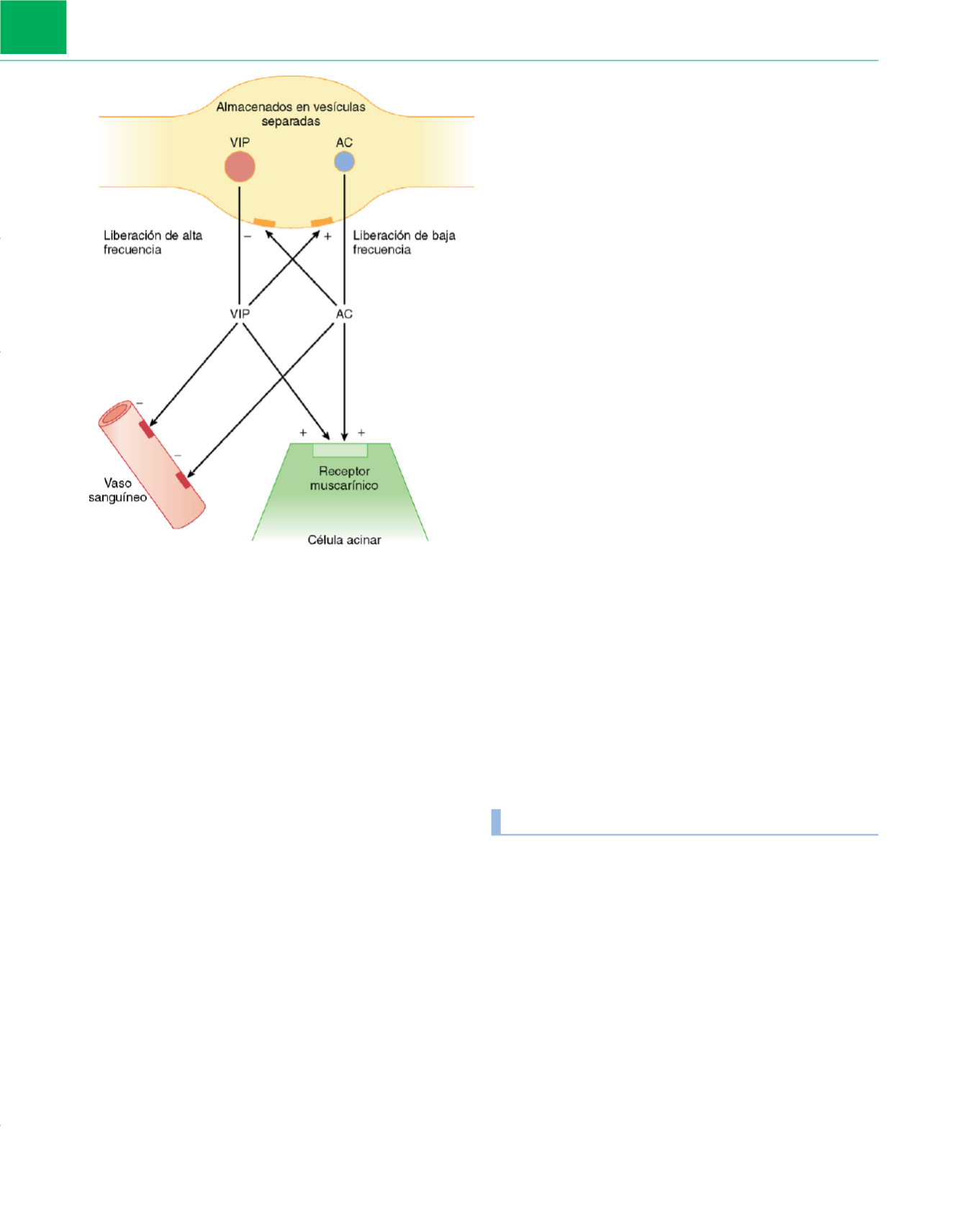
Un transmisor clásico como la acetilcolina coexiste con el
VIP en los nervios parasimpáticos de diversos órganos, aunque, en
este caso, los dos transmisores se almacenan en vesículas separadas.
En función de su localización, pueden ser liberados diferencial-
mente con distintas frecuencias de estimulació
n 82,83. Por ejemplo,
en las glándulas salivales, actúan independientemente sobre las
células acinares y los vasos sanguíneos glandulares (v.
fig. 2-15 ) 73 .La cooperación se consigue por liberación selectiva de acetilcolina
a bajas frecuencias y de VIP a frecuencias elevadas de estimulación.
También se han descrito elementos de modulación pre y postsináp-
tica. Cada vez es mayor la evidencia de que, en muchos estados
biológicos, incluidos gestació
n 84 ,hipertensión y envejecimiento, las
relaciones entre cotransmisores pueden ser un factor determinante
de la respuesta compensatoria para permitir un control más preciso
de importantes funciones fisiológicas. Por otra parte, la gran diver-
sidad de receptores ofrece numerosos objetivos para potenciales
intervenciones farmacológicas.
Farmacología ganglionar
Los ganglios desempeñan funciones más complejas que las de
actuar como simples enlaces entre el proceso nervioso de una
célula y el cuerpo celular de su siguiente conexión. Las funciones
de integración y procesamiento contribuyen a fomentar la sensibi-
lidad de la respuesta y la organización del SNA. La electrofisiología
de la estimulación ganglionar es compleja, con al menos cuatro
tipos de respuestas a la estimulación eléctrica
( tabla 2-8 ) 85 .El elemento central de la función del ganglio es el potencial
postsináptico excitatorio (PPSE) cuando la acetilcolina interactúa
con un receptor nicotínico de tipo neuronal para despolarizar la
membrana postsináptica. La despolarización deriva fundamental-
mente del flujo de entrada de iones de sodio a través del canal del
receptor nicotínico y es sensible a fármacos bloqueantes nicotíni-
cos no despolarizantes, como el hexametonio. Los otros cambios
en el potencial eléctrico se relacionan con vías secundarias o sub-
sidiarias de aumento o supresión. Dichas vías son insensibles a los
antagonistas nicotínicos clásicos.
Figura 2-15
Un transmisor clásico, la acetilcolina (AC), coexiste con el
polipéptido intestinal vasoactivo (VIP) en los nervios parasimpáticos que
inervan las glándulas salivales del gato. La AC y el VIP se almacenan en
vesículas separadas; pueden liberarse de manera diferenciada a distintas
frecuencias de estimulación para actuar sobre las células acinares y los vasos
sanguíneos glandulares. Se consigue cooperación mediante la liberación
selectiva de AC a frecuencias de impulso bajo y de VIP a frecuencias elevadas.
Está indicada la modulación pre y postsináptica. (
De Burnstock G: Local
mechanisms of blood flow control by perivascular nerves and endothelium
.
J Hypertens Suppl
8:S95, 1990.
).









