
ADNc se conoció la estructura primaria de la preprodinorfina, el
precursor de la dinorfina.
En 1995 se aisló un nuevo péptido opioide endógeno con
una secuencia homóloga a la dinorfin
a 3,4. Este péptido se deno-
minó orfanina FQ, o nociceptina, debido a que en determinadas
circunstancias disminuye el umbral del dolor, al contrario que los
otros péptidos opioides endógenos. Los estudios farmacológicos
y fisiológicos han demostrado que la nociceptina/orfanina FQ
tiene propiedades de modulación del comportamiento y del
dolor, que son distintas de las de los tres péptidos opioides clási-
co
s 10 .Los estudios del efecto que ejerce la nociceptina/orfanina
FQ en la sensación de dolor han arrojado resultados contradic-
torios, que pueden indicar que los efectos de este péptido depen-
den del estado subyacente del sujeto. La prepronociceptina, el
precursor de la nociceptina/orfanina FQ, se ha clonado, y su
secuencia de aminoácidos sugiere la existencia de neuropéptidos
derivados de la prepronociceptina distintos de la nociceptina/
orfanina F
Q 11.
La búsqueda de ligandos endógenos que se unan al receptor
m
con gran afinidad y alta selectividad llevó al descubrimiento de
una nueva clase de péptidos opioides endógenos, denominados
endomorfina-1 y endomorfina-
2 12 ,que son tetrapéptidos con la
secuencia Tyr-Pro-Trp-Phe y Tyr-Pro-Phe-Phe, respectivamente.
Todavía no se ha clonado el gen de la endomorfina, y queda mucho
por conocer acerca de la distribución anatómica, el modo de inte-
racción con los receptores opioides, el efecto in vivo y la posible
existencia de otros péptidos relacionados que son muy selectivos
para cada uno de los receptores opioides.
Mecanismo de transducción de la señal
molecular
Los receptores opioides pertenecen a la familia de los receptores
acoplados a la proteína G. Se ha probado que la activación de los
receptores opioides produce la activación de las proteínas G sensi-
bles a la toxina pertussis (G
i
y/o G
o
). La expresión del receptor
opioide clonado, en células cultivadas, por transfección del ADNc
clonado ha facilitado el análisis de los mecanismos de transducción
de la señal intracelular que se activan por los receptores opioides
( fig. 17-3 ) 2. La activación del receptor opioide inhibe la adenilato-
ciclasa y reduce el contenido celular de adenosinmonofosfato cíclico
(AMPc). Electrofisiológicamente se ha demostrado que, mediante
el receptor de los opioides, se inhiben los canales de Ca
2+
depen-
dientes de voltaje y se activan los canales de potasio de rectificación
interna. Como resultado, la activación de dichos receptores produce
una reducción de la excitabilidad neuronal. Por el contrario, también
se ha afirmado que los opioides pueden estimular la entrada de Ca
2+
en células neuronales cultivada
s 13. Recientemente se ha observado
que la cinasa relacionada con la señal extracelular, una clase de
proteincinasa activada por mitógenos, es activada por los receptores
opioide
s 14 .La activación inducida por los opioides de la cinasa rela-
cionada con la señal extracelular puede incrementar la liberación de
araquidonat
o 14y la expresión de los genes precoces c-fos y jun
B 15 .La exposición crónica de los receptores opioides a los agonis-
tas induce unos mecanismos de adaptación celular que podrían
estar implicados en la tolerancia, la dependencia y los síntomas de
Opioides
539
17
Sección
II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
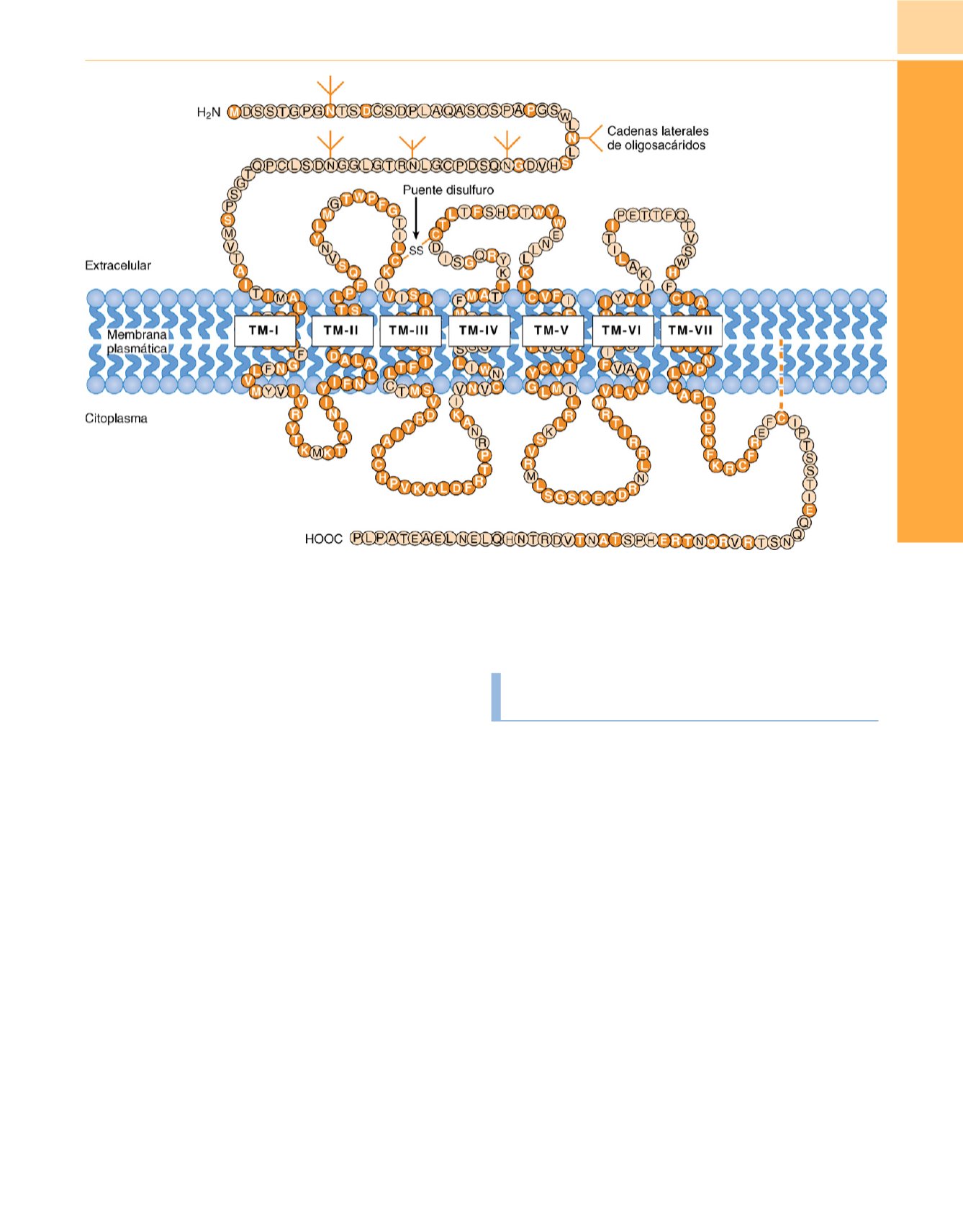
Figura 17-2
Propuesta de estructura del receptor opioide
m
. Los
círculos negros
muestran los residuos de aminoácidos idénticos en los receptores
m
y
d
. TM-I
a TM-VII muestran los supuestos segmentos transmembrana, compuestos residuos de aminoácidos hidrofóbicos.









