
privación. Numerosos investigadores han demostrado que la des-
ensibilización a corto plazo está probablemente relacionada con la
fosforilación del receptor opioide por la proteincinasa
C 16. Se han
implicado otras muchas cinasas, como la proteincinasa A y la cinasa
del receptor
b
-adrenérgico (
b
ARK
) 17. La
b
ARK fosforila selectiva-
mente los receptores unidos al agonista, y por tanto promueve la
interacción con la
b
-arrestina, que interfiere con el acoplamiento
de la proteína G y promueve la internalización del receptor. En un
ratón que carecía de
b
-arrestina 2 se intensificó una analgesia aguda
inducida por morfina, lo que sugiere que esta proteína influye en la
regulación de la respuesta a los opioides in viv
o 18 .Al igual que otros receptores acoplados a la proteína G, el
receptor opioide puede sufrir una internalización rápida mediada
por el agonista a través de la vía endocítica clásic
a 19,20. Este proceso
es inducido de distinta forma por diferentes tipos de ligando. Por
ejemplo, hay ciertos agonistas, como la etorfina y las encefalinas,
que producen una internalización rápida del receptor
m
, mientras
que la morfina, aunque también disminuye la actividad de la ade-
nilciclasa, no causa internalización del receptor
m 21 .Este hallazgo
sugiere que distintos ligandos pueden inducir diversos cambios en
la forma del receptor, con lo que producen diferentes aconteci-
mientos intracelulares. Es más, se podría encontrar explicación a
las diferencias que hay en la eficacia y el riesgo de abuso de los
distintos opioide
s 22.
Se considera que la tolerancia a largo plazo a los opioides se
debe a un aumento de la actividad de la adenilciclasa como con-
trarregulación al descenso de los niveles de AMPc que se observa
tras la administración aguda de opioide
s 23 .Este efecto se puede
prevenir con el pretratamiento de las células con toxina pertussis,
lo que demuestra la implicación de las proteínas G (G
i
+ y/o G
o
).
Mecanismo de la analgesia
Se ha de considerar el control del dolor que producen los opioides
dentro del contexto de los circuitos cerebrales que modulan la
analgesia y en el marco de la función de los distintos tipos de
receptores que existen en estos circuito
s 24. Se ha establecido que su
efecto analgésico deriva de su capacidad de inhibir directamente
la transmisión ascendente de la información nociceptiva desde el
asta dorsal de la médula espinal y de activar los circuitos de control
del dolor que descienden desde el mesencéfalo a través de la mé-
dula ventromedial rostral (MVR) hasta el asta dorsal de la médula
espinal. En un estudio realizado por Petrovic y cols. con un modelo
experimental de dolor en el que utilizaron la tomografía de emisión
de positrones (PET) para estudiar los mecanismos de acción del
remifentanilo, un agonista
m
de acción ultracorta, se observó que
el fármaco producía una activación de la corteza cingulada rostral
anterior, de la ínsula, de la corteza orbitofrontal y de áreas del tron-
co cerebra
l 25 .Estas últimas zonas se solapaban con zonas cerebrales
previamente implicadas en la modulación del dolor, como la mate-
ria gris periacueductal (MGP). Resulta interesante recordar que
la analgesia producida por placebo actúa de forma similar sobre
esas zonas, probablemente a través de la liberación de opioides
endógeno
s 26.
Los estudios inmunohistoquímicos y los análisis de hibrida-
ción in situ han probado que los receptores opioides se expresan
en distintas zonas del sistema nervioso central (SNC
) 5 .Entre dichas
zonas se encuentran la amígdala, la formación reticular mesence-
fálica, la MGP y la MVR. Sin embargo, el papel de los receptores
opioides en todas estas zonas no se conoce completamente.
La microinyección de morfina en la MGP o la estimulación
eléctrica directa de esta zona produce una analgesia que se puede
bloquear con naloxona. El efecto de los opioides en la MGP influye
en la MVR, que a su vez modula la transmisión nociceptiva en el
asta dorsal de la médula espinal a través de la acción de la vía de
inhibición descendente. Por tanto, los opioides no sólo causan
analgesia por el efecto directo en la médula espinal, sino también
por la interacción con las neuronas localizadas en lugares distantes
al sitio donde se administran los opioides.
La distribución de los receptores opioides en los circuitos
descendentes del control del dolor indica que hay una gran super-
540
Farmacología y anestesia
II
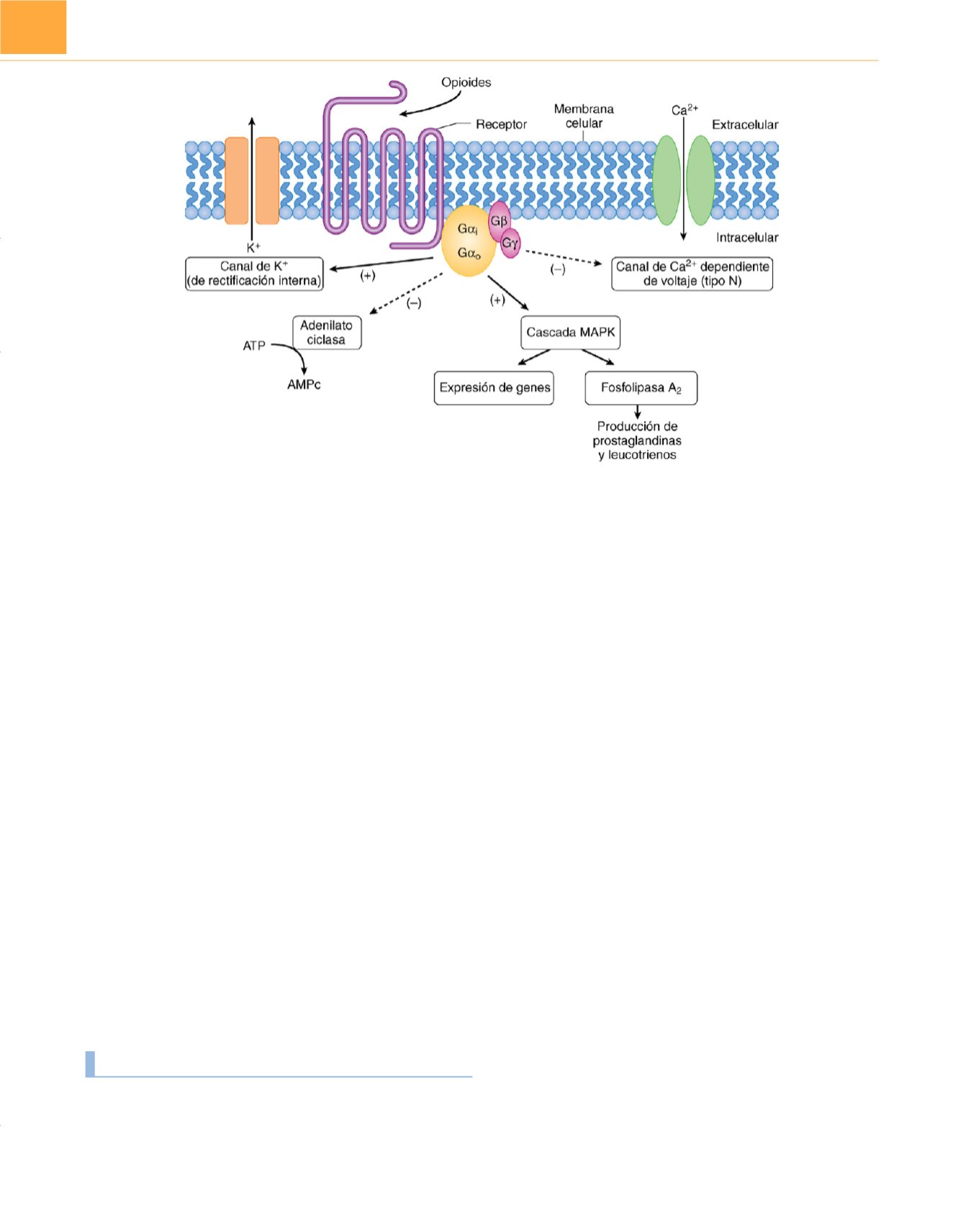
Figura 17-3
Mecanismos de transducción de la señal intracelular relacionados con los receptores opioides. El agonista opioide se une al receptor opioide,
produciendo activación de la proteína G. Se inhiben la actividad de la adenilatociclasa y la de los canales de Ca
2+
dependientes de voltaje. Por otro lado, se activan
los canales de K
+
de rectificación interna y la cascada de la proteincinasa activada por mitógenos (MAPK). AMP, adenosinmonofosfato; ATP, adenosintrifosfato.









