
neuronal probablemente recorra un espectro en el que algunas neu
ronas sufren necrosis o apoptosis mientras que en otras la muerte celular tiene características de ambas, necrosis y apoptosis.
Cronología de la muerte neuronal
El concepto tradicional de daño isquémico era que la muerte
neuronal se restringía al período de isquemia y al período de
reperfusión precoz. Sin embargo, datos más recientes indican que
el daño neuronal postisquémico es un proceso dinámico en el que
las neuronas siguen muriendo durante un largo período después
de la lesión isquémica inicial
( fig. 3-18 ) 259. Esta muerte neuronal
diferida, que se demostró primero en modelos de isquemia cere-
bral global, ha sido demostrada también durante la isquemia focal.
La extensión de la muerte neuronal diferida depende de la grave-
dad de la lesión isquémica. En una isquemia grave, la mayoría de
las neuronas mueren rápidamente. Con lesiones isquémicas más
moderadas, las neuronas que sobreviven a la lesión inicial pueden
morir de forma diferida. Esta pérdida neuronal progresiva con-
tribuye a la expansión gradual del infarto cerebral después de la
isquemia focal. En estudios experimentales, se ha demostrado
la evidencia de inflamación cerebral, que puede teóricamente con-
tribuir a daños posteriores, incluso 6-8 meses después de la isque-
mia inicial.
Que se produzca una muerte neuronal diferida tiene impor-
tantes implicaciones para la evaluación de estudios en los que se
investigan estrategias neuroprotectoras. Una gran cantidad de
medidas han mostrado tener eficacia neuroprotectora en estudios
en los que la extensión del daño se ha evaluado a los 3-4 días pos-
teriores a la isquemia. Sin embargo, esta eficacia neuroprotectora
puede no ser sostenida. Datos recientes indican que el infarto cere-
bral sufre una expansión gradual y que una reducción del daño
atribuible a una intervención terapéutica determinada ya no es
aparente cuando la lesión se evalúa después de un prolongado
período de recuperación postisquémic
a 259 .Por tanto, es importante
hacer una evaluación de la eficacia a largo plazo (más de 1 mes) de
una intervención particular.
Protección cerebral
La bibliografía sobre isquemia cerebral y protección cerebral es
amplia y un abordaje detallado de este tema sobrepasa los objetivos
de este trabajo. Existen muchas excelentes revisiones actualizadas
sobre estos tema
s 256,260-262 .Consideraciones relevantes en la isquemia global
completa (parada cardíaca)
Mantener una presión de perfusión adecuada después de sufrir una
parada cardíaca es de máxima importancia. La hipotensión que
tiene lugar después de una reanimación tras una parada cardíaca
puede agravar los procesos vasoespásticos y microcirculatorios que
ocurren en ese momento e incrementar el daño cerebral. Puede
producirse hipertensión intracraneal en una fase tardía debido al
desarrollo de edema cerebral extenso, probablemente de etiología
tanto citotóxica como vasogénica, asociado a necrosis cerebral. Los
intentos para controlar este tipo de hipertensión intracraneal con
osmoterapia suelen fracasar. Por lo general no se utiliza la monito-
rización de la PIC porque los pacientes que desarrollan aumentos
tardíos de la PIC tienen un daño tisular masivo y sostenido.
Después de una parada cardíaca se han administrado tanto
barbitúricos como bloqueantes de los canales de calcio. Los primeros
no son efectivo
s 263. En una pequeña cohorte de víctimas de paradas
cardíacas (51 pacientes), se observó que el nimodipino mejoraba el
FSC pero no el pronóstico neurológic
o 264. En un segundo ensayo que
reclutó aproximadamente a 150 víctimas de paradas cardíacas, no se
observó ningún beneficio general en el pronóstico neurológic
o 265. Sin
embargo, en un subgrupo de pacientes en los que la aplicación de las
técnicas de soporte vital avanzado se retrasó más de 10 minutos, se
observó una mejoría en la supervivencia. Este único estudio no
puede servir para justificar la administración de nimodipino después
de una parada cardíaca, especialmente a la vista de los resultados
inequívocamente negativos del estudio multicéntrico con lidoflazina
en casos de parada cardíac
a 266. Una vez más, los objetivos terapéuti-
cos importantes son el mantenimiento de la normocapnia y la nor-
motensión, la normalización del pH sistémico, evitar la hipertermia,
y prevenir y tratar las crisis epilépticas.
La inducción de una hipotermia leve es eficaz para reducir
la morbimortalidad de pacientes que han sufrido una parada car-
díac
a 267 .La inducción de una hipotermia leve, entre 32 y 34 °C
durante un período aproximado de 24 horas, mejoró el pronóstico
neurológico y la supervivencia 6 meses después de producirse una
parada cardíaca cuando se comparaba con el grupo isotérmico. La
hipotermia suave pudo inducirse con facilidad. El recalentamiento
pasivo de los pacientes se realizó lentamente durante un período
de 8 horas. La incidencia de complicaciones fue similar a la del
grupo control isotérmico. Este importante estudio es uno de los
primeros que ha demostrado la viabilidad y eficacia de la hipoter-
mia inducida como tratamiento para prevenir lesiones por una
isquemia global. No hay duda de que la hipotermia inducida se va
a añadir ahora al arsenal terapéutico para el tratamiento de las
complicaciones cerebrales de la parada cardíaca.
Consideraciones relevantes en la isquemia focal
(incompleta)
Antes de abordar cada fármaco de manera individual, hay que
señalar que un tema general que se puede extraer de la bibliografía
sobre protección por anestésicos, sobre todo por anestésicos inhala-
torios, es que la anestesia por sí misma es protectora. Parece ser que,
por razones no definidas, la reducción del nivel de estrés sistémico
Fisiología cerebral y efectos de los anestésicos
93
3
Sección I
Fisiología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
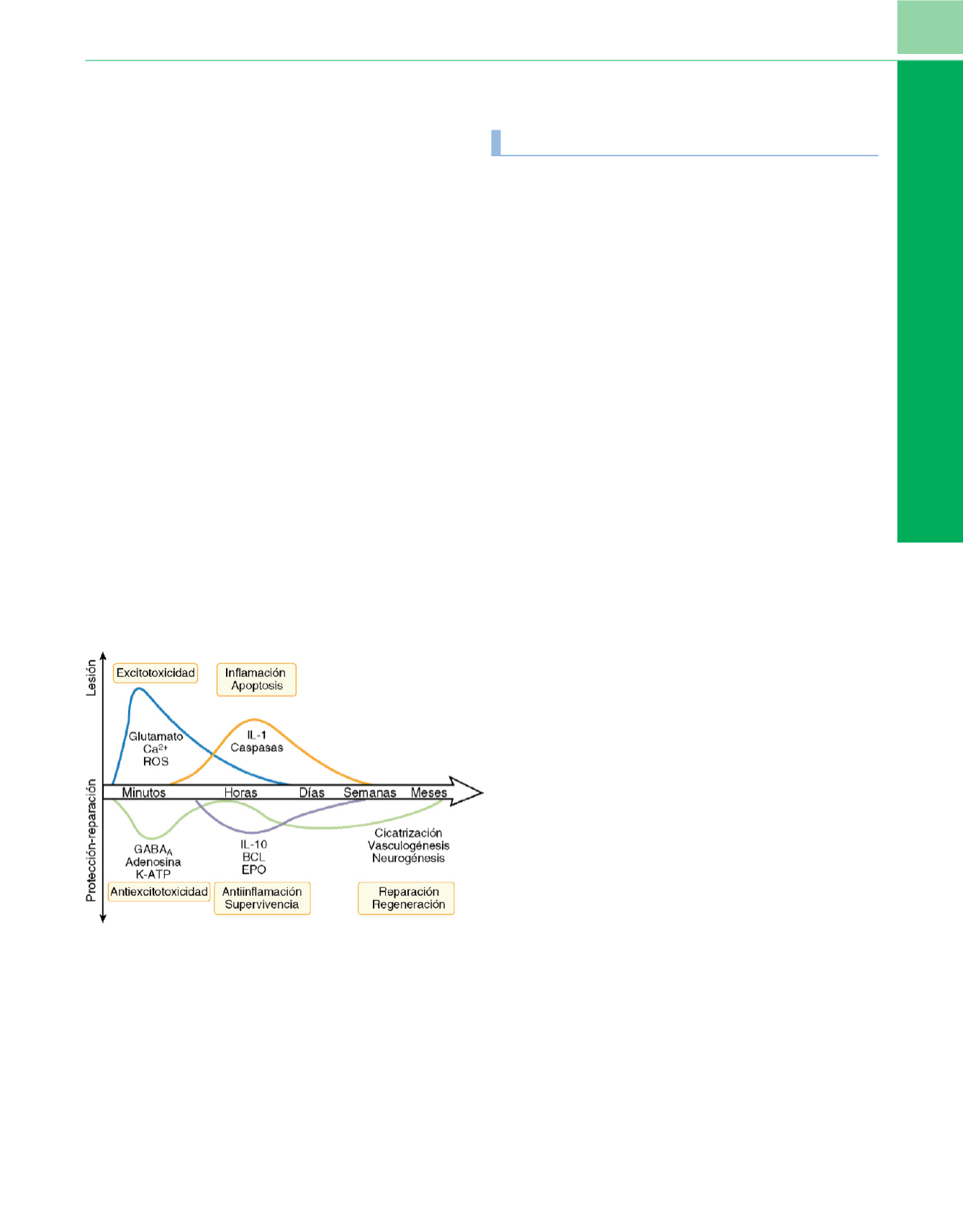
Figura 3-18
Evolución en el tiempo de la muerte neuronal. El daño por
excitotoxicidad (mediado por glutamato) produce muerte neuronal dentro de
las primeras horas después del inicio de la isquemia. El daño tisular cerebral
evoca una respuesta inflamatoria, un proceso importante en la retirada del
tejido dañado y la cicatrización, que conduce a una cantidad sustancial de daño
colateral. La muerte neuronal mediada por inflamación puede continuar durante
varios días. Puede producirse apoptosis neuronal en neuronas dañadas que han
sobrevivido a la lesión inicial. Se ha demostrado que la muerte neuronal
apoptótica se produce bastantes días después de la lesión isquémica inicial. En
la actualidad, está claro que la muerte neuronal isquémica es un proceso
dinámico en el que las neuronas continúan muriendo durante un período
prolongado.
(Adaptada de Dirnagl U, Iadecola C, Moskowitz MA: Pathobiology
of ischaemic stroke: an integrated view.
Trends Neurosci
22:391-397, 1999.)









