
la endotelina y el óxido nítrico. Las intervenciones quirúrgicas,
como el pinzamiento aórtico transversal, la circulación extracor-
pórea (CEC), los diuréticos y las infusiones de sustancias vasoac-
tivas (p. ej., vasopresina, agonistas dopaminérgicos y adrenérgicos)
se superponen a estos factores endógenos.
El volumen de orina y el aclaramiento de agua libre pueden
disminuir durante la anestesia espinal como resultado del aumento
de la secreción de ADH. La mayor actividad simpaticomimética
reduce el FSR por mecanismos
a
-adrenérgicos y aumenta la libe-
ración de renina mediante la inervación
b
-adrenérgica de forma
directa o por interacción con la mácula densa tubular renal y el
mecanismo del reflejo barorrecepto
r 79-82 .Hay que destacar que se
ha demostrado que la anestesia epidural torácica aumenta el FSR
y la diuresis en modelos animales de shock endotóxic
o 83 .Dos revisiones amplias recientes sobre anestesia epidural
han obtenido hallazgos relacionados con los pronósticos renales
perioperatorios. Moraca y cols
. 81,82realizaron un metaanálisis y
describieron la asociación de la anestesia epidural torácica con
la mejora de los pronósticos quirúrgicos, atribuible en parte a la
reducción de la morbilidad perioperatoria, incluida la atenuación
de la respuesta al estrés, la disminución de las infecciones y del íleo,
así como la reducción de la pérdida de sangre y de la IRA. Liu y
W
u 80revisaron 18 metaanálisis, 10 revisiones, 8 ensayos clínicos
aleatorizados y controlados, así como 2 estudios observacionales
sobre analgesia epidural y observaron que los datos respaldan la
capacidad de la analgesia epidural para reducir las complicaciones
cardiovasculares y pulmonares, como la morbilidad renal tras la
cirugía vascular mayor en pacientes de alto riesgo.
Efectos de los anestésicos inhalatorios
Los anestésicos inhalatorios volátiles más antiguos tienen un efecto
nefrotóxico bien conocido, que se ha atribuido a la liberación de
fluoruro inorgánico cuando se metabolizan (v. cap. 14
) 84. El metoxi-
flurano (que ya no se usa en clínica) y el enflurano, cuando se
utilizan durante períodos prolongados (9,6 concentración alveolar
mínima [CAM]-horas), dan lugar a la producción significativa de
fluoruro inorgánic
o 84-87. El aumento de las concentraciones séricas
de fluoruro inorgánico produjo insuficiencia renal poliúric
a 84,85.
Alrededor de 100 casos publicados de insuficiencia renal y 20 falle-
cimientos relacionados con una causa renal atestiguan la relevancia
de la nefrotoxicidad relacionada con el metoxifluran
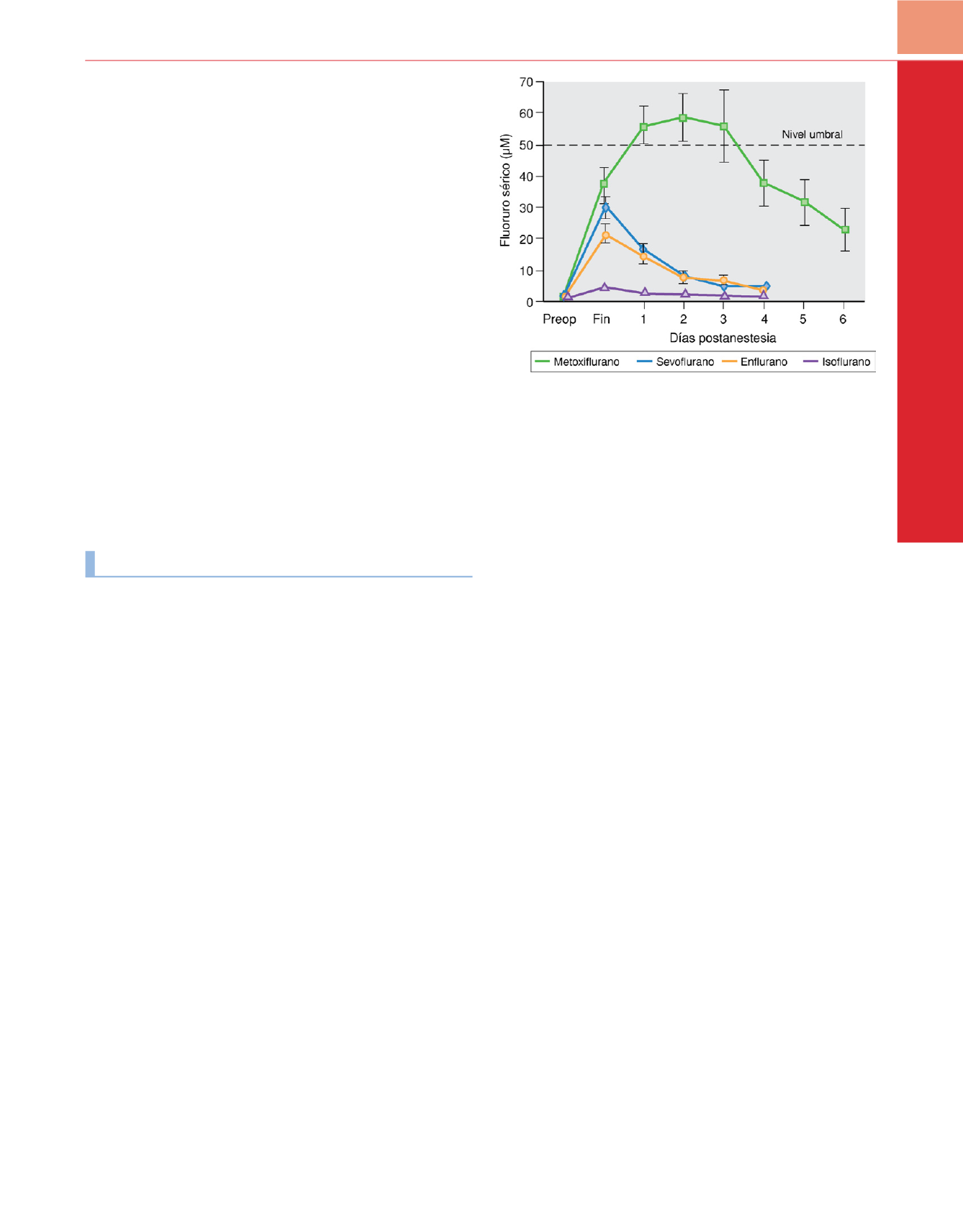
o 84 .Debido a que el metabolismo del sevoflurano es similar al del
enflurano en lo referente a la liberación de iones fluoruro libre
s 84,88-91 ( fig. 35-8 ), surgieron preocupaciones durante su desarrollo por la
posibilidad de que este fármaco también pudiese alterar la capaci-
dad renal de concentrar la orin
a 89,92 .Los estudios con metoxiflurano
indicaron que era probable la aparición de LRA con concentracio-
nes circulantes de fluoruro mayores de 50
m
M/
l 84,86 .Este umbral
supuestamente tóxico se extrapoló al estudio de otros fármacos
anestésicos halogenados,como el enflurano y el sevoflurano (v.
fig.35-8 ).
Curiosamente, la concentración plasmática media de fluoruro en
voluntarios es alrededor del doble de alta con el sevoflurano que
con el enflurano, y el 43% de los voluntarios que reciben sevoflu-
rano tienen unas concentraciones plasmáticas de fluoruro superio-
res a 50
m
M/l. Los pacientes sanos que reciben 9 CAM-horas de
anestesia con sevoflurano tienen concentraciones séricas de fluo-
ruro de un promedio de 36,6±4,3
m
M/
l 88,93. Sin embargo, respecto
al metoxiflurano, la alta concentración de fluoruro es breve, alcanza
un máximo a las 2 horas del final de la anestesia y disminuye un
50% en 8 horas. A pesar de la alta concentración de fluoruro con el
sevoflurano, los voluntarios no presentan ninguna alteración de su
capacidad para concentrar orina en respuesta a la desmopresina,
mientras que el 20% de los voluntarios que reciben enflurano tienen
unos déficits transitorios de concentración el día 1, pero no el día
5 tras la exposició
n 93 .Para interpretar estos hallazgos, los investiga-
dores plantearon que la producción intrarrenal del ion fluoruro
puede ser más relevante para la nefrotoxicidad que sus concentra-
ciones plasmáticas circulante
s 91 .El metabolismo intrarrenal de
metoxiflurano es cuatro veces mayor que el del sevoflurano.
Se han buscado otras explicaciones de las diferencias de los
efectos renales de los fármacos volátiles, como la evaluación de la
variación de los compuestos nefrotóxicos producidos cuando un
anestésico inhalatorio interactúa con los absorbentes de CO
2
. En
los sistemas de los circuitos de respiración, a alta temperatura y
bajos flujos, estos absorbentes degradan el sevoflurano y dan lugar
a fluorometil-2,2-difluoro-1-(trifluoroetil) vinil éter, denominado
también compuesto A. Un paso del metabolismo del compuesto A
consiste en la conjugación hepática con glutatión y, después, la
modificación renal por una enzima (cisteinconjugado
b
-liasa).
Algunos metabolitos del compuesto A pueden producir lesión
renal, que se caracteriza por diuresis, glucosuria, proteinuria y
elevación de las concentraciones séricas de BUN y creatinina. La
LRA secundaria a este mecanismo en modelos experimentales
depende del grado y la duración de la exposición al compuesto A
94 ,con unos umbrales de exposición bien definidos en ratas para
producir lesión (50-114ppm durante 3 horas) y el fallecimiento
(331 durante 3 horas, 203 durante 6 horas o 127 ppm durante
12 horas
) 95 .Sin embargo, existen disparidades entre los resultados
en ratas y en el ser humano que pueden deberse a diferencias en
el metabolismo del compuesto A; de las cuatro vías conocidas para
dicho metabolismo, tres no implican a la
b
-liasa renal ni causan
toxicidad renal. El ser humano tiene una actividad de
b
-liasa renal
10-30 veces menor en comparación con las ratas, lo que puede
explicar la ausencia de lesión renal por el sevoflurano en él. En un
estudi
o 96se comparó la seguridad de anestesia con flujo bajo de
sevoflurano e isoflurano en pacientes sometidos a cirugías prolon-
gadas (
>
6h). La CAM-horas media en ambos grupos fue similar,
y la concentración media del compuesto A en el grupo del sevo-
flurano fue de 20±7ppm. Los marcadores de lesión renal, como el
BUN, creatinina,
N
-acetil-
b
-d-glucosaminidasa (NAG) y alanina
aminopeptidasa, aumentaron de forma similar en todos los grupos
durante la exposición prolongada a los anestésicos volátiles.
Monitorización de la función renal
1217
35
Sección III
Control de la anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
Figura 35-8
El efecto nefrotóxico de los anestésicos inhalatorios volátiles más
antiguos se atribuye a la liberación de fluoruro inorgánico cuando se
metabolizan. La LRA relacionada con el metoxiflurano se relaciona con un
umbral de concentración circulante de fluoruro mayor de 50
m
M/l. Las
concentraciones de fluoruro inorgánico no se correlacionan tan estrechamente
con el riesgo de LRA para los anestésicos volátiles modernos como el
sevoflurano.
(Con autorización de Mazze RI: Methoxyflurane revisited: tale of
an anesthetic from cradle to grave
. Anesthesiology
105:843-846, 2006.)









