
En la acidosis metabólica el cloruro se excreta preferente-
mente por el riñón. En la alcalosis metabólica se retiene cloruro,
mientras que se excreta sodio y potasio. La presencia de bicarbo-
nato en la orina refleja la necesidad de mantener la neutralidad
eléctrica. Las alteraciones del manejo renal de cloruro pueden ser
responsables de diversos trastornos acidobásicos hereditarios. En
la acidosis tubular renal hay imposibilidad de excretar Cl
−
en pro-
porción al Na
+ 32 .El diagnóstico se puede hacer por la presencia de
acidosis metabólica hiperclorémica con concentraciones anormal-
mente bajas de Cl
−
en la orina: la DIF urinaria es positiva. Si la DIF
urinaria es negativa el proceso no es renal. De forma similar, el
seudohipoaldosteronismo parece deberse a una reabsorción elevada
de clorur
o 33 .El síndrome de Bartter está producido por una muta-
ción del gen que codifica el canal de cloruro (CLCNKB) que regula
al cotransportador de Na–K–2Cl (NKCC2
) 34 .Las otras causas de
acidosismetabólica hiperclorémica son pérdidas digestivas (diarrea,
drenaje del intestino delgado o del conducto pancreático), nutri-
ción parenteral, administración excesiva de suero salino y uso de
inhibidores de la anhidrasa carbónica.
Herramientas analíticas utilizadas
en la química acidobásica
Los libros de texto y la práctica clínica han tendido a sobrestimar
la importancia de los cambios aislados de la concentración de los
iones de hidrógeno y de bicarbonato. El significado clínico de las
alteraciones acidobásicas está determinado por la causa subya-
cente, más que por la concentración sérica de iones de hidrógeno
y de hidroxilo en sí misma. Sin embargo, la química acidobásica
sigue siendo un pilar de la interpretación de los datos clínicos
debido a su disponibilidad ubicua, su bajo coste y su aceptación
universal. Sin embargo, la exactitud de las mediciones del equilibrio
acidobásico no está determinada por la gasometría sanguínea, que
mide el ácido volátil y el pH, por sí sola. Es esencial la medición de
todos los iones fuertes y débiles que influyen en la disociación del
agua, aunque sea difícil.
Los trastornos acidobásicos se describen mejor por las alte-
raciones de la Pco
2
, la DIF y la A
TOT
. Muchos abordajes utilizados
para enseñar y describir el estado acidobásico de un paciente no
permiten explicar adecuadamente muchas alteraciones acidobásicas
que se ven con frecuencia en el período perioperatorio (p. ej., aci-
dosis dilucional o hiperclorémica) y son confusos en relación con
la causa del problema (p. ej., la acidosis dilucional está producida
por reducción de la DIF, y no por dilución del bicarbonato).Aunque
es importante considerar los abordajes utilizados desde una pers-
pectiva histórica, los abordajes modernos del estudio del equilibrio
acidobásico se centran en la química física para calcular la magnitud
de la alteración de la DIF (hiato de ácidos fuertes [HAF]) o para
recalcular el déficit o el exceso de bases utilizando DIF y A
TOT
(v.
fig. 39-4 ). En esta sección vamos a analizar algunas de las herramien
tas que se han desarrollado en los últimos 50 años para facilitar la
interpretación de los trastornos acidobásicos. Ninguna es total-
mente exacta, y cada una tiene su grupo de seguidore
s 35 .Abordaje del dióxido de carbono-bicarbonato (de Boston)
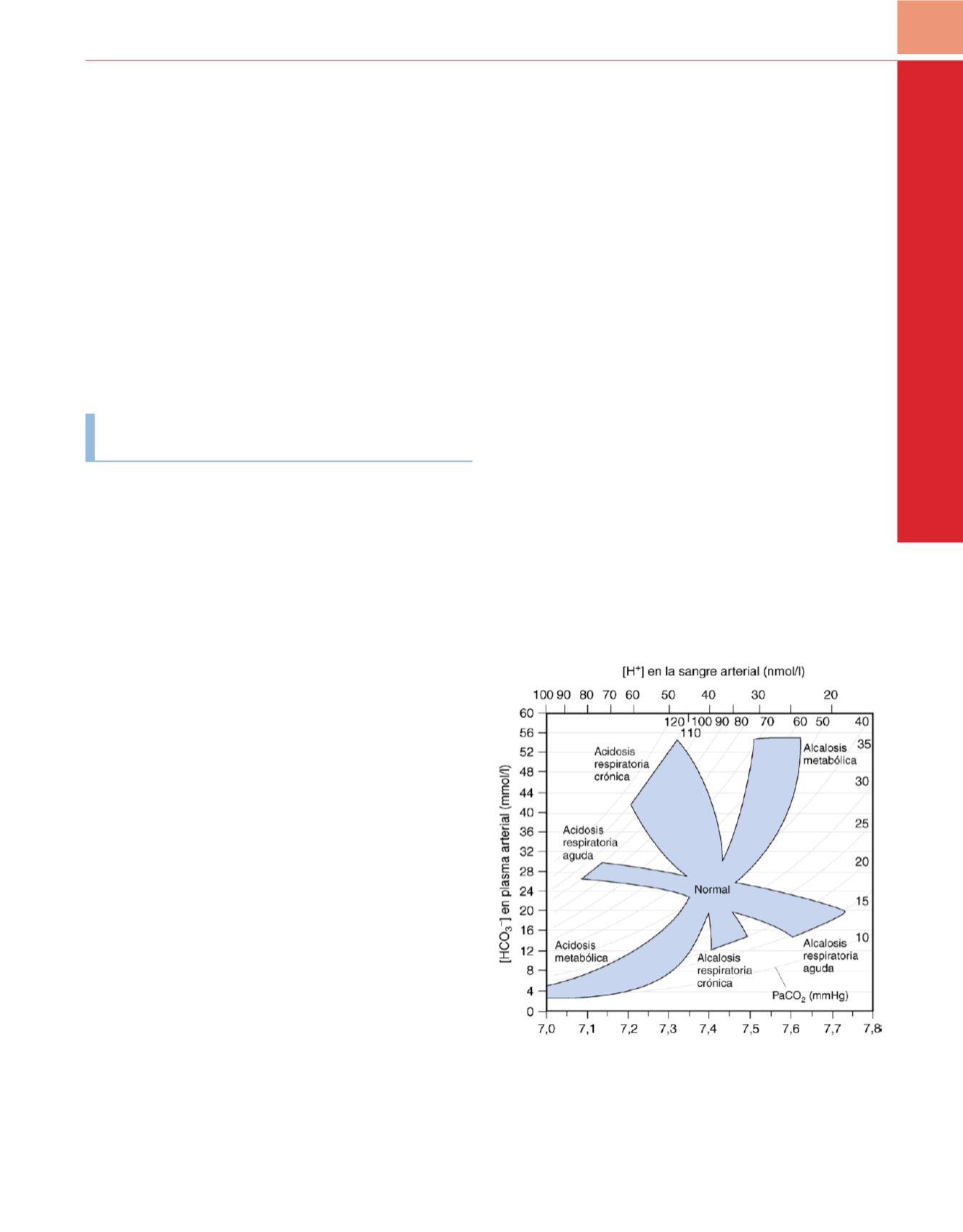
Schwartz y cols., de la Tufts University de Boston, desarrollaron un
abordaje de la química acidobásica utilizando mapas del estado
acidobásico y la relación matemática entre la presión parcial de CO
2
y el bicarbonato sérico (o el CO
2
total), derivada de la ecuación de
Henderson-Hasselbalch para predecir la naturaleza de los trastornos
acidobásicos (v.
tabla 39-1). Se evaluó a pacientes con trastor
nos acidobásicos conocidos en estado estable de compensación. Se
midió el grado de compensación respecto a lo que se consideraba
normal para cada una de las enfermedades. Los investigadores des-
cribieron seis estados principales de desequilibrio acidobásico utili-
zando ecuaciones lineales omapas que relacionaban la concentración
de iones de hidrógeno con la Pco
2
para los trastornos respiratorios,
y la Pco
2
con la concentración de HCO
3
−
para los trastornos meta-
bólicos
( fig. 39-2 ). Para cualquier trastorno acidobásico dado se
determinaba una concentración esperada de HCO
3
−
. Para las alte-
raciones más sencillas se trata de un abordaje razonable.
Utilizando estos mapas y ecuaciones los médicos han podido
determinar la naturaleza de la mayoría de los trastornos acidobá-
sicos respiratorios y metabólicos. Aunque se incluye una relación
matemática, las alteraciones de H
+
y HCO
3
−
no reflejan una rela-
ción entre causa y efecto. La hipoventilación crónica se asocia a
aumento de Pco
2
y de HCO
3
−
. Muchos médicos han atribuido
incorrectamente el aumento de HCO
3
−
a la compensación del
aumento de la Pco
2
. No ocurre así. El aumento de la concentración
de HCO
3
−
refleja el aumento del CO
2
total en el cuerpo. Las alte-
raciones del HCO
3
−
reflejan su importancia como amortiguador,
subproducto del CO
2
y ácido débil.
Aunque el abordaje de Pco
2
-HCO
3
−
es exacto para la mayoría
de los trastornos, tiene diversos inconvenientes inherentes, particu-
larmente en relación con el componente metabólico. Primero, el abor-
daje no es tan sencillo como parece. Exige que el médico consulte
mapas confusos o que aprenda fórmulas y realice cálculos mentales.
Segundo, el sistema ni explica ni tiene en consideración muchas de
las complejas alteraciones acidobásicas que se ven en pacientes perio-
peratorios y en pacientes graves, como acidosis aguda en el contexto
de hipoalbuminemia, acidosis hiperclorémica y acidosis dilucional, y
acidosis láctica en el contexto de la acidosis respiratoria crónica.
Abordaje del déficit/exceso de bases (de Copenhague)
Singer y Hasting
s 36fueron los pioneros de un abordaje alternativo
de la química acidobásica en 1948. Su método se alejó de la ecua-
ción de Henderson-Hasselbalch e intentó cuantificar el compo-
Equilibrio acidobásico perioperatorio
1329
39
Sección III
Control de la anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
Figura 39-2
Nomograma del estado acidobásico utilizando el abordaje de
Boston. Se pueden distinguir distintos trastornos acidobásicos de acuerdo
con los valores relativos de la presión parcial del dióxido de carbono (Pa
co
2
) y
la concentración de iones de bicarbonato ([HCO
3
−
]).
(Adaptado de Brenner
BM, Rector FC:
The Kidney,
3.
a
ed. Filadelfia, WB Saunders, 1986, pág. 473.)









