
se comprobó aplicando estimulación al nervio frénico, lo que
redujo el área atelectásic
a 72. Sin embargo, el efecto fue pequeño, y
esta técnica es demasiado complicada para su uso habitual durante
la anestesia y la cirugía.
M
aniobras
de
reclutamiento
. Se ha propuesto el uso de
una maniobra de suspiro, o un V
C
doble, para reabrir el tejido
pulmonar colapsad
o 73 .Sin embargo, la atelectasia no disminuye
con un V
C
doble o con un suspiro hasta una presión en la vía aérea
de 20 cmH
2
O 67. Sólo cuando se alcanza una presión de 30 cmH
2
O
la atelectasia disminuye hasta casi la mitad del tamaño inicial. Para
la reapertura completa de todo el tejido pulmonar colapsado es
necesaria una presión de insuflación de 40 cmH
2
O
( fig. 5-20 ). Esta
insuflación tan grande corresponde a una inspiración espontánea
máxima, por lo que se puede llamar maniobra a VC.
Como una maniobra a VC puede tener consecuencias car-
diovasculares adversas, se analizó la dinámica de la resolución de
la atelectasia durante esta técnic
a 74. Se halló que en adultos con
pulmones sanos, la inflación de los pulmones hasta+40 cmH
2
O
mantenida durante no más de 7-8 segundos puede reexpandir todo
el tejido pulmonar previamente colapsado.
M
inimización de
la
reabsorción de gas
. La ventilación de
los pulmones con oxígeno puro después de una maniobra a VC que
había reabierto el tejido pulmonar previamente colapsado dio lugar a
la reaparición rápida de la atelectasi
a 75. Por otro lado, si se utiliza O
2
al 40% en nitrógeno para la ventilación de los pulmones, la atelectasia
reaparece lentamente, y 40 minutos después de la maniobra de VC
sólo había reaparecido el 20% de la atelectasia inicial. Por tanto, la
ventilación durante la anestesia se debe realizar con una fracción
moderada de oxígeno inspirado (p. ej., Fio
2
de 0,3-0,4) y se debe
aumentar únicamente si hay deterioro de la oxigenación arterial.
Los llamativos efectos del oxígeno durante la anestesia plantea-
ron la duda de si la «preoxigenación» durante la inducción de la
anestesia influye sobre la formación de atelectasia. La respiración de
O
2
al 100%durante unos pocos minutos antes de la anestesia y durante
el comienzo de la misma aumenta el margen de seguridad en caso de
intubación difícil de la vía aérea con apnea prolongada. Sin embargo,
146
Fisiología y anestesia
I
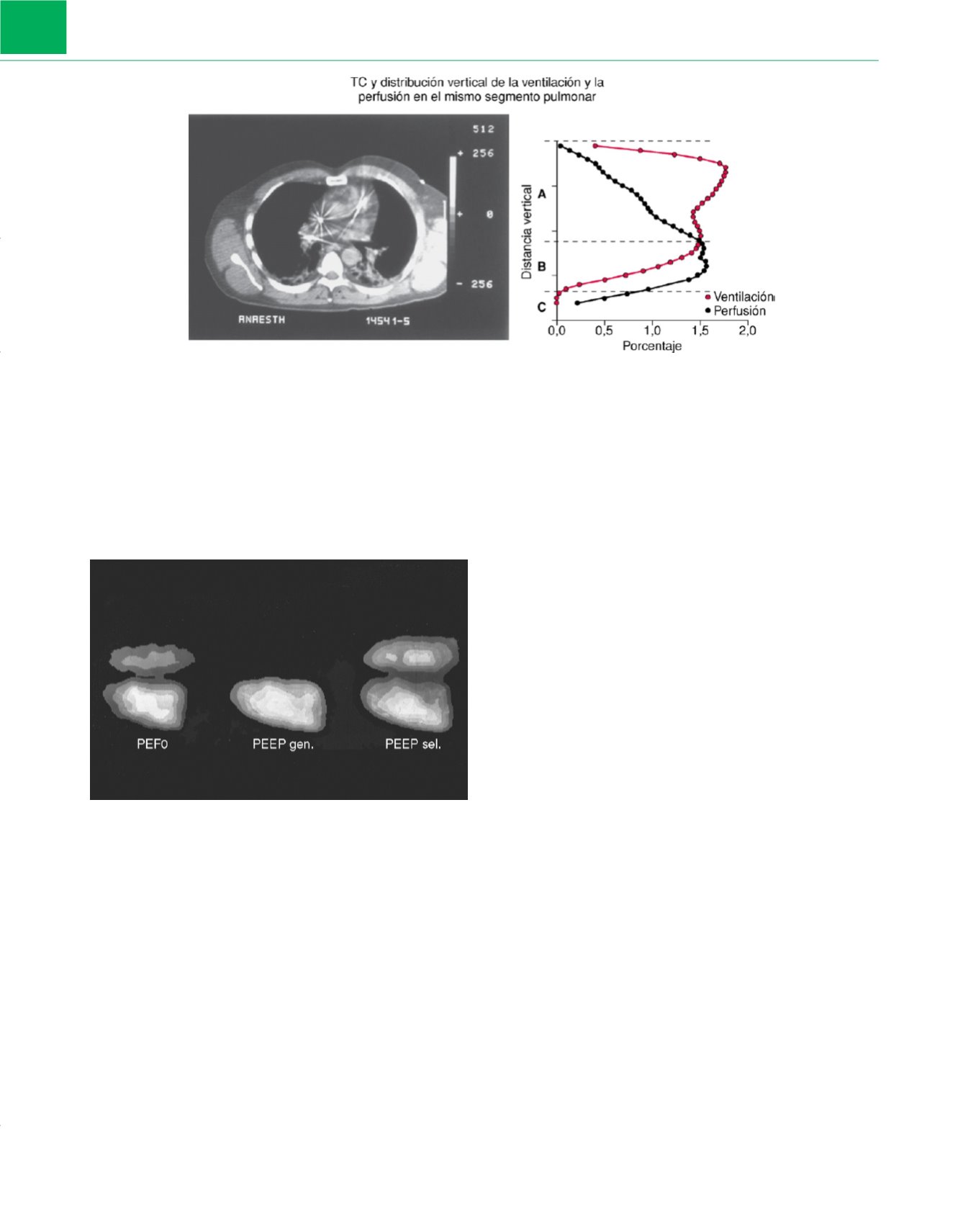
Figura 5-18
Corte transverso de tomografía computarizada (TC) con atelectasia en las partes inferiores de ambos pulmones
(imagen izquierda)
en una
persona anestesiada. Obsérvese que la ventilación se distribuye de manera preferente hacia las regiones pulmonares superiores, al contrario de lo que se ve
en las personas en vigilia. La ventilación supera a la perfusión a ese nivel, lo que da lugar a un efecto de espacio muerto, o de ventilación desperdiciada
(zona A de la
imagen derecha
). Obsérvese también la disminución de la ventilación en la mitad inferior del pulmón, de modo que la perfusión es mayor a ese
nivel. Esto da lugar al denominado cociente V˙
A
/Q˙ bajo y produce deterioro de la oxigenación sanguínea. El cierre intermitente de la vía aérea es el probable
mecanismo subyacente a la reducción de la ventilación (zona B). Hay interrupción completa de la ventilación en la parte inferior, que corresponde a la zona
atelectásica. Sin embargo, sigue habiendo perfusión, por lo que se produce un cortocircuito (zona C). También se puede ver que la perfusión aumenta hacia las
zonas inferiores del pulmón, excepto en la región más inferior, en la que se puede ver una disminución. Esta denominada zona IV puede estar producida por
un aumento de la presión pulmonar intersticial que comprime a los vasos extraalveolares, y por una vasoconstricción pulmonar hipóxica.
(Reproducida a partir
de datos de Tokics L, Hedenstierna G, Svensson L y cols.: V/Q distribution and correlation to atelectasis in anesthetized paralyzed humans.
J Appl Physiol
81:1822-1833, 1996
.
)
Figura 5-19
Imágenes gammagráficas de la distribución del flujo
sanguíneo pulmonar en una persona anestesiada en decúbito lateral.
Durante la ventilación mecánica con presión espiratoria final cero (PEF0)
la perfusión va principalmente al pulmón inferior, aunque hay cierta
perfusión del pulmón superior, de modo que la distribución media en el
pulmón superior es del 33-40% de la perfusión pulmonar total. Con una
PEEP general de 10 cmH
2
O la perfusión queda comprimida hacia abajo,
hacia el pulmón inferior, y en este ejemplo particular casi no hay
perfusión en absoluto en el pulmón superior. Esto produce un importante
efecto de espacio muerto. Por otro lado, si la PEEP se aplica
selectivamente al pulmón inferior, en este ejemplo 10 cmH
2
O, la perfusión
se podría redistribuir al pulmón superior para que hubiera una
distribución más homogénea entre los dos pulmones. Debe quedar claro
que el tamaño de los pulmones superior e inferior, tal y como se
muestran en la imagen, no refleja el volumen pulmonar sino el tejido
pulmonar perfundido. Cabría esperar que el pulmón superior fuera mayor
que el pulmón inferior en decúbito lateral.
(D
e
Hedenstierna G,
Baehrendtz S, Klingstedt C y cols.: Ventilation and perfusion of each
lung during differential ventilation with selective PEEP.
Anesthesiology
61:369-376, 1984.)









