
Vasoconstricción pulmonar hipóxica
Se ha encontrado que varios anestésicos inhalados inhiben la VPH
en preparaciones de pulmón aislado. Sin embargo, no se ha obser-
vado este efecto con anestésicos intravenosos (barbituratos
) 84 .Los
resultados de estudios en seres humanos son variables, lo que posi-
blemente se pueda explicar por la complejidad del experimento,
que hace que haya diversas variables que cambian al mismo tiempo.
Por tanto, la respuesta de la VPH se puede ver alterada por cambios
simultáneos del gasto cardíaco, la contractilidad miocárdica, el
tono vascular, la distribución del volumen sanguíneo, el pH y la
presión parcial de CO
2
de la sangre, y la mecánica pulmonar. En
estudios sin cambios significativos del gasto cardíaco, el isoflurano
y el halotano atenúan la respuesta de la VPH en un 50% a una
concentración alveolar mínima (CAM) de 2
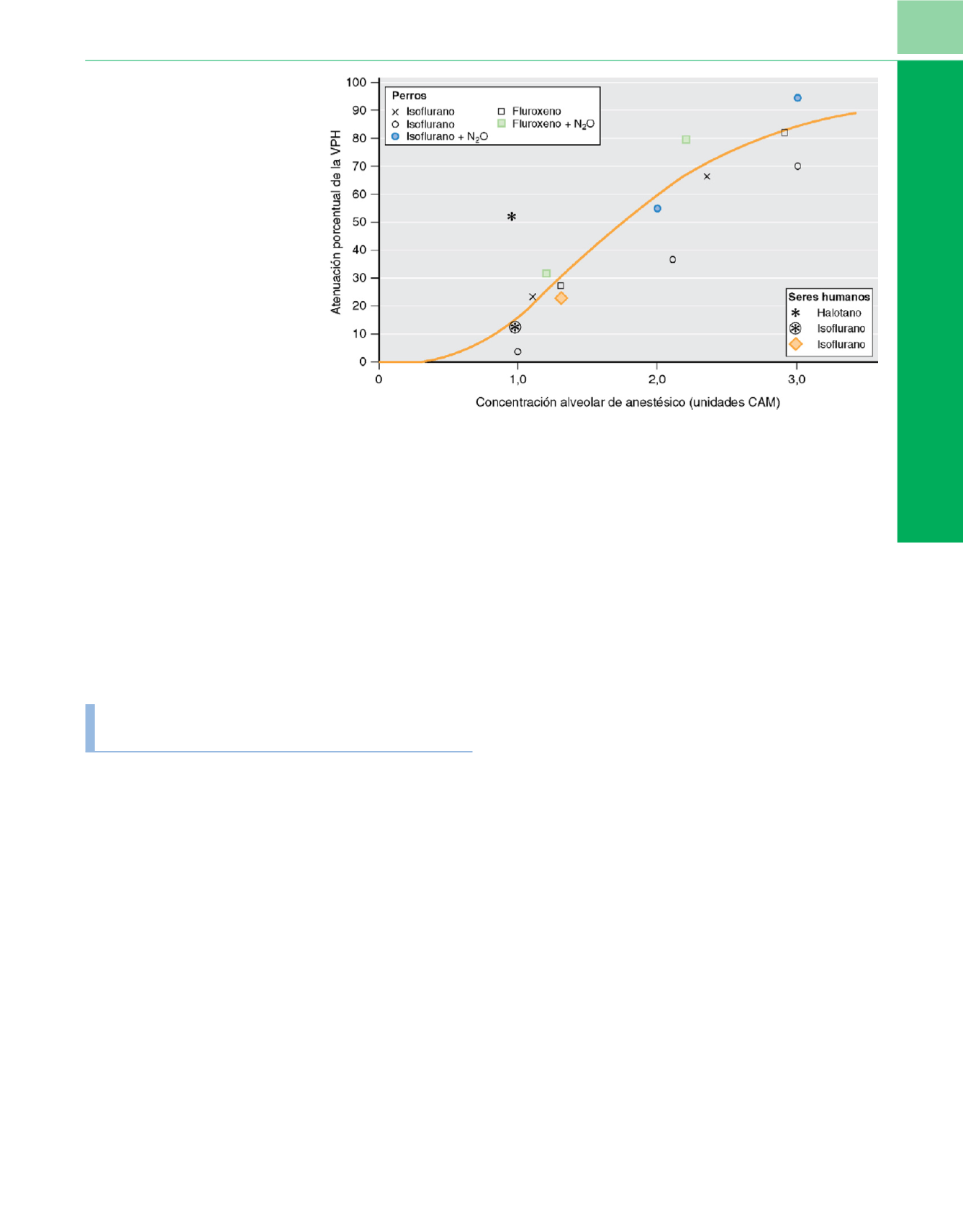
( fig. 5-23 ) 85.
Equilibrio ventilación-perfusión durante
la anestesia
Espacio muerto, cortocircuito y relaciones
ventilación-perfusión
Durante la anestesia se produce una alteración de la eliminación del
CO
2
y de la oxigenación en la mayoría de los pacientes. La reducción
de la eliminación del CO
2
se puede atribuir a un aumento de la
ventilación del espacio muerto. Registros con eliminación en respi-
ración única han demostrado que el espacio muerto «anatómico» no
se modifica, lo que indica que durante la anestesia debe haber
aumentado el espacio muerto «alveolar» o paralel
o 73 .Mediante la
técnica de MIGET se ve que el aumento del espacio muerto de CO
2
durante la anestesia no es realmente espacio muerto, sino regiones
pulmonares poco perfundidas que se caracterizan por cocientes
V˙
A
/Q˙ elevados
( fig. 5-24 ). Estos cocientes «V˙
A
/Q˙ elevados» se pueden
explicar por la minúscula perfusión de los vasos de los ángulos
de los tabiques interalveolares de las regiones superiores (en los que
la presión alveolar puede superar a la presión vascular pulmonar
[zona I]
) 52. La reducción de la eliminación del CO
2
se puede corregir fá
cilmente aumentando la ventilación y raras veces plantea problemas
en la anestesia habitual con ventilación mecánica.
Se considera que, en general, el deterioro de la oxigenación
arterial durante la anestesia es más grave a edades avanzadas, la
obesidad empeora la oxigenación de la sangre, y los fumadores
tienen más deterioro del intercambio gaseoso que los no fumado-
re
s 86,87. La mezcla venosa, que se calcula según la ecuación estándar
del «cortocircuito» del oxígeno, también aumenta durante la aneste-
sia hasta aproximadamente el 10% del gasto cardíaco. Sin embargo,
la mezcla venosa incluye no sólo la perfusión de tejido pulmonar
no ventilado (cortocircuito verdadero), sino también regiones poco
ventiladas o con un exceso de perfusión en relación con la ventila-
ción («regiones de V˙
A
/Q˙ bajo»). La magnitud en la que la mezcla
venosa incluye regiones de cocienteV˙
A
/Q˙ bajo depende de la fracción
de oxígeno inspirado (Fio
2
).Cuantomayor sea la fracción de oxígeno
inspirado, menos regiones de cocienteV˙
A
/Q˙ bajo habrá. Sin embargo,
con valores elevados de Fio
2
las regiones con cociente V˙
A
/Q˙ bajo se
pueden colapsar por absorción del gas y se pueden transformar en
regiones de cortocircuit
o 88 .En un estudio de 45 pacientes anestesia-
dos se vio buena correlación entre la mezcla venosa, y la suma del
cortocircuito «verdadero» y la perfusión de «regiones de cociente
V˙
A
/Q˙ bajo»
( fig. 5-25 ) 63 .En el
cuadro 5-3se muestra la derivación
del «cortocircuito de oxígeno» o mezcla venosa.
Durante la anestesia con tiopental y metoxiflurano de volun-
tarios sanos jóvenes, tanto la ventilación como la perfusión se
distribuyeron en intervalos mayores de cocientes V˙
A
/Q˙ , lo que
se puede expresar como un aumento de la desviación típica loga-
rítmica de la distribución de la perfusión (log SDQ). En un grupo
de pacientes similar al que se estudió durante la anestesia con
halotano y la parálisis muscular, el log SDQ aumentó a casi el doble,
desde 0,43 en vigilia hasta 0,80 durante la anestesia. Además, el
cortocircuito verdadero aumentó hasta una media del 8%. En un
estudio de pacientes quirúrgicos de mediana edad (de 37-64 años)
se observó un aumento similar del cortocircuito desde el 1% en
vigilia hasta una media del 9% durante la anestesia, y hubo ensan-
chamiento de la distribución de los cocientes V˙
A
/Q˙ (log SDQ 0,47
en vigilia y 1,01 durante la anestesia). En pacientes ancianos con
un deterioro más grave de la función pulmonar, la anestesia con
halotano con parálisis muscular, con o sin óxido nitroso, produjo
un marcado ensanchamiento de la distribución de los cocientes
V˙
A
/Q˙ , con aumento de log SDQ desde 0,87 en vigilia hasta 1,73
durante la anestesia. Además, el cortocircuito aumentó hasta un
promedio del 15%, con una gran variación entre pacientes (del
0-30%). Así, los hallazgos más constantes durante la anestesia son
un aumento del desequilibrio de V˙
A
/Q˙ , que se expresa como un
aumento de log SDQ, y un aumento del cortocircuito. Se puede ver
una revisión de este punto en el artículo de Hedenstiern
a 52.
Fisiología respiratoria
149
5
Sección I
Fisiología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
Figura 5-23
Atenuación de la
vasoconstricción pulmonar hipóxica (VPH) en
relación con la concentración alveolar
mínima del anestésico (unidades de CAM).
Obsérvese que durante la anestesia con
diferentes anestésicos inhalados con una
CAM de 1 se puede ver una reducción de la
VPH de aproximadamente el 20-30%, y que
con concentraciones mayores del anestésico
puede haber una atenuación mucho mayor
de la VPH. La consecuencia es que no se
reducirá la perfusión a través de una región
no ventilada, como ocurre en la atelectasia,
con mayores concentraciones del
anestésico.
(De Marshall BE. Hypoxic
pulmonary Vasoconstriction.
Acta
Anaesthesiol Scand
94:37-41, 1990
.
)









