
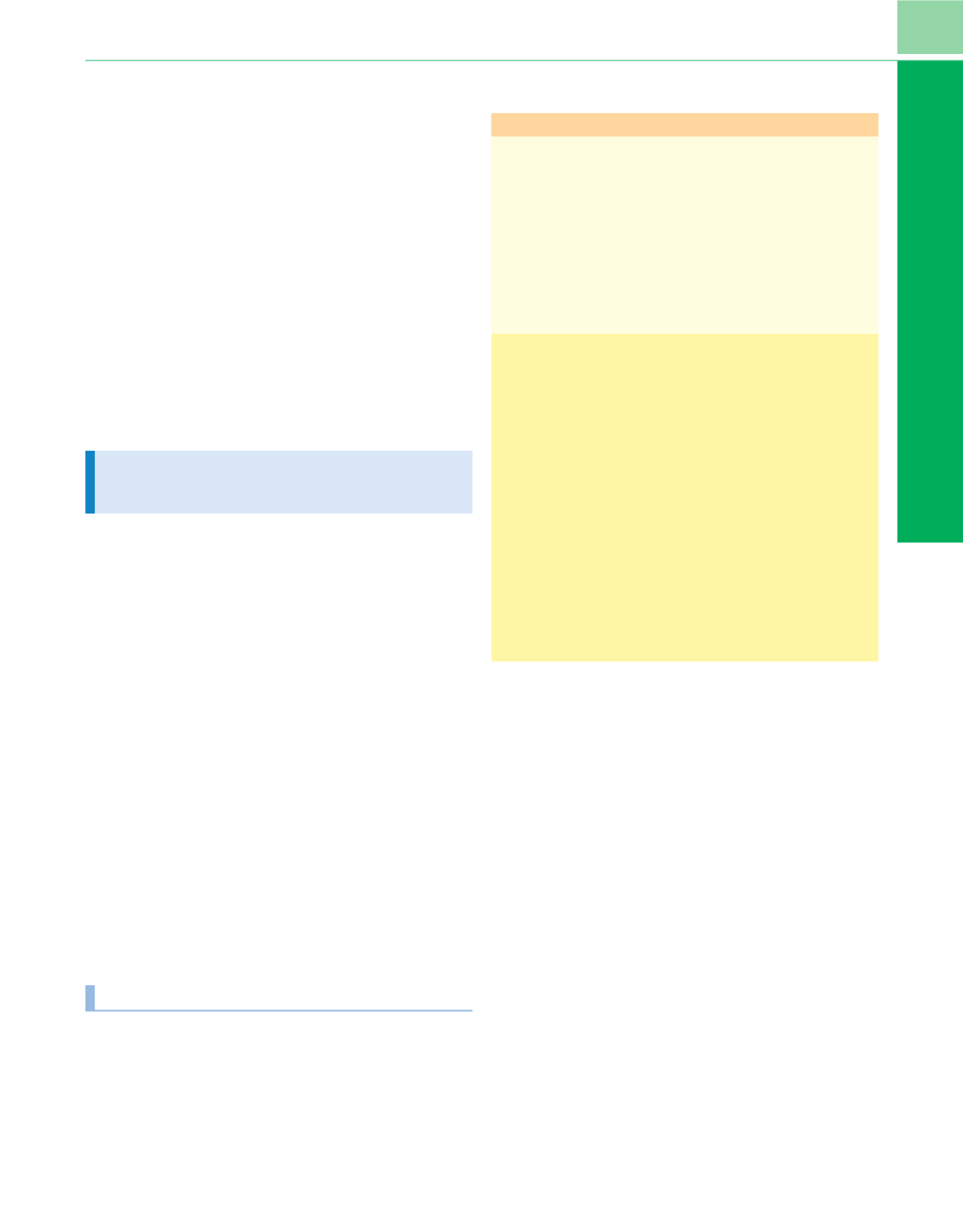
Se han identificado dos clases de receptores de la AVP: recep-
tores V2 y V1a/b (V2R y V1a/bR, respectivamente), que son recepto-
res acoplados a la proteína G de siete dominios transmembrana. Los
V2R se localizan principalmente en la membrana apical de las células
que revisten los túbulos colectores del riñón (en especial, en la cortical
y en la membrana externa de los túbulos colectores medulares). La
estimulación de estos receptores da lugar a la inserción de aguaporina
2 (canales de agua) en la membrana celular, lo que permite que el
agua sea reabsorbida a través de un gradiente osmótico y media la
respuesta antidiurética de AVP. La activación de V1aR induce vaso-
constricción y un aumento de la producción de prostaglandinas
renales (en particular, prostaglandina E
2
y prostaciclina), y la estimu-
lacióndeV1bR facilita la liberacióndeACTHpor la hipófisis. Cuando
es secretada en el plasma, la AVP es metabolizada rápidamente en el
hígado y los riñones (semivida en circulación: 15-20min
) 11 .La sed es el mecanismo más importante para la ingestión de
agua en el paciente que conserva la consciencia. La osmolalidad
plasmática y el volumen circulante efectivo son los principales
determinantes de la regulación del mecanismo de la sed. Además,
otras señales pueden estimularla (p. ej., angiotensina II y relaxina)
o inhibirla (p. ej., ANP
) 12 .Homeostasia hídrica del período
postoperatorio
El mantenimiento de un equilibrio hídrico óptimo constituye un
reto en el período perioperatorio. Tras un período de ayuno deter-
minado, los pacientes llegan al quirófano con un balance negativo.
La intervención puede provocar una hemorragia, pérdidas hídricas
por evaporación y secuestro del líquido en el tercer espacio. Además,
la anestesia puede afectar al equilibrio hídrico por las interaccio-
nes de los anestésicos con la fisiología y distribución normal de los
líquidos; por ejemplo, la anestesia neuroaxial puede inducir una
simpaticólisis con vasoplejía de la parte declive del cuerpo. Además,
la regulación del equilibrio hídrico por la sed es ineficaz en el
período perioperatorio porque los pacientes no están por completo
despiertos y en estado de alerta. Aunque los déficit hídricos que se
presentan se reponen durante la intervención con diversos líquidos
(cristaloides, coloides y hemoderivados), las alteraciones de la
homeostasia hídrica son frecuentes cuando el paciente llega al lugar
de reanimación (p. ej., sala de reanimación, unidad de cuidados
intermedios o unidad de cuidados intensivos).
El objetivo de la fluidoterapia en el período postoperatorio
es proporcionar la cantidad y tipo óptimo de líquido al paciente.
Por tanto, el paciente debe permanecer euvolémico con una distri-
bución normal de electrólitos. La hipovolemia y la hipervolemia
son los extremos de la alteración del equilibrio hídrico y se abor-
darán en esta sección, porque la fisiopatología de estos síndromes
clínicos debe conocerse con detalle para obtener una fluidoterapia
óptima. En este capítulo se presta atención al equilibrio hídrico y
no al electrolítico. Para una consulta adicional sobre el equilibrio
electrolítico, véase el capítulo 44.
Hipovolemia
La hipovolemia
absoluta
o depleción verdadera del volumen, en
general hace referencia a un estado de pérdida combinada de agua
y Na
+
que supera la ingestión o administración de líquidos y da
lugar a una disminución del volumen de LEC. En comparación,
la deshidratación guarda relación con una pérdida de agua aislada
que se traduce en un aumento de la concentración plasmática de
Na
+
y un déficit intracelular posterior de agua (movimiento osmó-
tico de agua desde el compartimento LIC a LEC). Por otra parte,
la hipovolemia
relativa
hace referencia a un estado caracterizado
por una disminución del volumen circulante efectivo, pero con un
volumen normal o expandido de LEC. En función del paciente
(edad, estado físico y enfermedades coexistentes), un cierto grado
de depleción del volumen suele ser bien tolerado. No obstante, con
un aumento del grado de hipovolemia (absoluta o relativa) y una
deshidratación progresiva, la perfusión tisular puede limitarse,
dando lugar a un síndrome clínico denominado shock
( tabla 78-4 ).
El aporte de oxígeno deja de ajustarse a las necesidades de oxige-
nación tisular y se desarrolla una acidosis metabólica. En el estadio
inicial, la acidosis es consecuencia de una disminución del aclara-
miento (no sobreproducción) de lactato por el hígado, riñones y
músculo esquelétic
o 13. No obstante, a medida que el shock progresa
y se desarrolla insuficiencia circulatoria con hipoxia tisular,
aumenta el metabolismo anaeróbico con una mayor producción de
lactato, lo que agrava la acidemia. A pesar de que, inicialmente, los
efectos de la perfusión tisular insuficiente son reversibles, la priva-
ción prolongada de oxígeno provoca una hipoxia celular generali-
zada y la alteración de los procesos bioquímicos decisivos, incluida
la alteración de la función de las bombas iónicas de la membrana
celular, edema intracelular y extravasación del contenido intrace-
lular al espacio extracelular. Estas anomalías rápidamente son irre-
versibles y dan lugar secuencialmente a la muerte celular, lesión de
Fluidoterapia intravascular postoperatoria
2553
78
Sección VI
Cuidados postoperatorios
© ELSEVIER. Fotocopiar sin autorización es un delito
Tabla 78-4
Causas de deterioro del volumen circulante efectivo
y clasificación de los síndromes caracterizados por shock
Fisiopatología
Síndrome clínico
Disminución del volumen de LEC
Shock hipovolémico
Pérdida extrarrenal de volumen/Na
+
Piel y aparato respiratorio
Gastrointestinal
Secuestro en el tercer espacio
Shock no hemorrágico
Hemorragia
Shock hemorrágico
Pérdida renal de volumen/Na
+
Diuresis osmótica, diuréticos
Nefropatías perdedoras de sal
Hipoaldosteronismo
Diabetes insípida
Shock no hemorrágico
Expansión o volumen normal de LEC Shock cardiogénico,
distributivo
Patología cardíaca y extracardíaca
Miocardio: insuficiencia de la bomba
Mecánica: valvulopatías, defecto septal
ventricular, tumores
Arritmias
Extracardíaca (obstructiva):
enfermedades del pericardio, embolia
pulmonar masiva, hipertensión
pulmonar aguda, neumotórax a tensión
Shock cardiogénico
Redistribución de líquidos
Shock distributivo
SRIS, sepsis
SRIS, shock séptico
Toxinas bacterianas y otras
Síndrome del shock tóxico
Anafilaxia y reacciones anafilactoides
Shock anafiláctico
Lesión del sistema nervioso central o de
la médula espinal
Shock neurogénico
Coma mixedematoso, crisis addisoniana Shock endocrino
Hepatopatía crónica
SRIS, síndrome de respuesta inflamatoria sistémica.









