
predispone a sufrir una LPIV es la distribución heterogénea de la
enfermedad pulmonar. Los estudios clave con tomografía computari-
zada han documentado claramente que en el pulmón con SDRA
coexisten áreas ventiladas normalmente con áreas mal aireadas, conso-
lidadas o hiperinfladas
( fig. 83-7 ) 60 .Una revisión sistemática del patrón
de distribución de estas regiones permitió clasificar el patrón de distri-
bución de las atelectasias en focales (
≈
36% de los pacientes, en los que
coexistían áreas declives consolidadas con áreas superiores con una
aireación normal), difusas (
≈
23%, con opacificación pulmonar genera-
lizada), e irregulares (
≈
41%, con áreas consolidadas distribuidas des-
igualmente por todo el pulmón
) 60-62. Esta heterogeneidad afecta
profundamente las características mecánicas del sistema respiratorio,
como queda documentado por la forma «estática» o «casi estática» de
la curva de presión-volumen inspiratorio del sistema respiratori
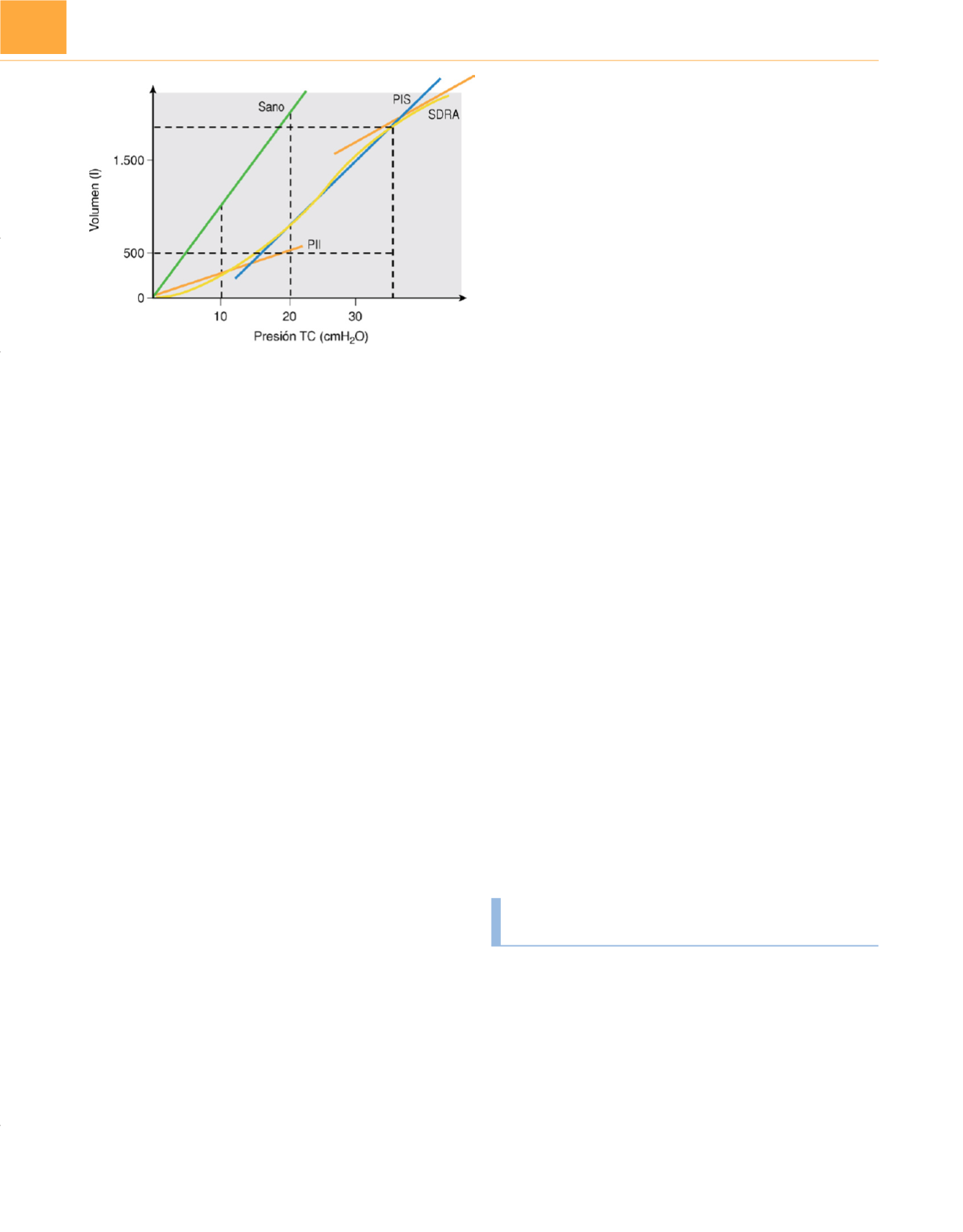
o 63 .Cuando el sistema respiratorio se infla con incrementos de volumen
diferenciados, o de un modo muy lento, el aumento en la presión de
apertura de la vía respiratoria reflejará las variaciones en las propiedades
elásticas del sistema respiratorio. El aumento progresivo de la distensi-
bilidad al comienzo del inflado pulmonar («punto de inflexión inferior»
[PII]) sugiere que los alveolos colapsados al final de la espiración están
abriéndose progresivamente durante el inflado (reclutamiento alveo-
lar), mientras que la disminución progresiva de la distensibilidad hacia
el final del inflado («punto de inflexión superior» [PIS]) sugiere que
algunos alveolos están estirándose progresivamente (hiperinflado) al
final del inflado. En la población normal, el PII tiene lugar por debajo
del punto de equilibrio elástico del sistema respiratorio y el PIS aparece
a un volumen próximo a la capacidad pulmonar total. En los pacientes
con SDRA, el PII y el PIS aparecen durante la ventilación corriente, e
indican la presión a la que comienzan a producirse el reclutamiento de
los alveolos colapsados y el hiperinflado alveolar, respectivamente
( fig. 83-8). Sinembargo, estudios recientes sugierenque el reclutamiento
pulmonar a lo largo del segmento ascendente de la curva de presión-
volumen es un fenómeno progresivo y se ha observado una histéresis
significativa entre la curva de presión-volumen inspiratorio y espirato-
rio al realizar el trazado descendente (es decir, espiratorio) de la curva
de presión-volumen. Esto quiere decir, que una vez reclutadas, las áreas
atelectásicas suelen colapsarse a una presión inferior que la presión
necesaria para abrir los alveolos durante la inspiració
n 64,65 .Según el concepto de «pulmón infantil», propuesto original-
mente por Gattinoni y cols., la ventilación mecánica que proporciona
volúmenes corrientes «estándar» (es decir, el Vc que «normaliza» la
Pco
2
arterial) generará un hiperinflado alveolar corriente cíclico en las
regiones aireadas normalmente en los pacientes con SDR
A 66 .Además,
las unidades pulmonares colapsadas al final de la espiración se reabri-
rán durante el inflado si se aplican niveles bajos de PEEP, generando
un fenómeno de colapso y apertura alveolar corriente cíclico (o reclu-
tamiento alveolar). El reclutamiento alveolar corriente y el hiperinflado
corriente activan vías de señales intracelulares proinflamatorias en las
células epiteliales y endoteliales de los alveolos y en los macrófagos
residentes en el pulmón. Como consecuencia, los genes responsables
de la transcripción de mediadores proinflamatorios y antiinflamato-
rios se encuentran activados o desactivados, respectivamente, cau-
sando inflamación alveola
r 67 .Este «biotrauma» inducido por el
ventilador puede producirse después de períodos relativamente cortos
de ventilación mecánica, dando lugar a una respuesta inflamatoria
local, que se ve amplificada por el reclutamiento de neutrófilos, macró-
fagos y fibroblastos desde la región de pulmón lesionado
( fig. 83-9 ) 59 .Además, los estímulos mecánicos que actúan sobre la pared alveolar
son capaces de liberar trombomodulina (la molécula de superficie que
activa la proteína C mediante mecanismo proteolíticos) a partir de la
superficie de las células alveolares, disminuyendo la activación de la
proteína C en los alveolos. Por tanto, la LPIV también puede empeorar
el estado procoagulante y antifibrinolític
o 68 .Otras expresiones del
«biotrauma» son la alteración en la eliminación del edema alveolar por
la inactivación de las ATPasa Na
+
/K
+
tipo I y II de las células alveola-
re
s 69 ,la inhibición de la secreción de surfactante por las células epite-
liales de tipo I
I 70 ,y el aumento de producción de metaloproteinasas de
matri
z 71 .Todos estos mecanismos propuestos apoyan la idea de que la
LPIV puede actuar como el «desencadenante» del síndrome de dis-
función orgánica múltiple (MODS), como fue propuesto original-
mente por Slutsk
y 59y ha sido confirmado recientement
e 72 .Se han propuesto diversas estrategias ventiladoras «protectoras
del pulmón» paraminimizar la LPIV. Los estudios iniciales se basaron
en la medición de las curvas de presión-volumen
inspiratorio
del
sistema respiratorio. Aplicando un nivel de PEEP ligeramente supe-
rior al PII para evitar el colapso teleespiratorio y un Vc para obtener
una presión meseta teleespiratoria inmediatamente por debajo del
PIS se reducían las reacciones inflamatorias sistémicas y pulmonares
relacionadas con la LPI
V 73y la mortalidad relacionada con las
LPI
V 74,75 .Sin embargo, puede resultar erróneo seleccionar el nivel de
PEEP basándose en el trazado ascendente de la curva de presión-
volumen, debido al hecho de que el reclutamiento alveolar aumenta
por encima del PII (es decir, se trata de un fenómeno paninspiratorio
) 76 .Además, en la mayoría de los pacientes con SDRA existe una histé-
resis significativa entre los trazados ascendente y descendente de la
curva de presión-volumen, Por tanto, algunos autores han sugerido
la selección del nivel de PEEP basándose en el trazado
espiratorio
de
la curva de presión-volumen. Este proceder se llevaría a cabo cuando
se realiza una maniobra de capacidad vital para reclutar por completo
el pulmón, seguido de la administración decreciente de PEE
P 65 .Limitación al flujo espiratorio y PEEP
intrínseca (PEEPi)-AUTOPEEP
En condiciones normales el volumen pulmonar teleespiratorio
(EELV) de una persona en reposo se corresponde estrechamente con
el punto de equilibrio elástico del sistema respiratorio (la CRF). El
atrapamiento aéreo se produce cuando el tiempo disponible para la
espiración es menor que el tiempo necesario para el vaciado pasivo
de vuelta a la CRF. Por consiguiente, la presión alveolar seguirá
siendo positiva al final de la espiración, lo que genera una «hiperin-
flación dinámica», es decir, una presión alveolar teleespiratoria posi-
tiva, denominada PEEP intrínseca (PEEPi) o auto-PEE
P 77,78. El
volumen de aire atrapado puede valorarse midiendo la cantidad de
2656
Cuidados críticos
VII
Figura 83-8
Curvas de presión-volumen estáticas del sistema respiratorio
registradas en un paciente sano y en un paciente con SDRA. Tanto el PII
como el PIS se presentan durante la ventilación corriente e indican la presión
a la que comienza a tener lugar el reclutamiento de los alveolos colapsados y
el hiperinflado alveolar, respectivamente. Se remite al texto para la definición
de las abreviaturas.









