
estimula el efecto de este último. Además, aumenta la reactividad de
las plaquetas ex vivo, especialmente durante la sepsis. Las proteínas
de fase aguda contribuyen al estado procoagulante. Las concentracio-
nes de fibrinógeno están elevadas, al igual que las de la
a
1
-antitripsina
y
a
2
-macroglobulina, lo que inhibe la proteína C. El aumento de la
proteína de unión a C4 reduce la cantidad de proteína S libre, mien-
tras que la proteína C reactiva (CRP) aumenta la expresión del TF en
monocitos y neutrófilo
s 49 .Otros factores también inducen el estado
de hipercoagulabilidad, como son el daño tisular local (las células
endoteliales segregan PAI) y materiales como los monómeros de
metilmetacrilato y los restos de médula ósea. La hipercoagulabilidad
va desapareciendo gradualmente en el postoperatorio (días 3-7). Las
hormonas contrarreguladoras no provocan estados de hipercoagula-
bilidad, por el contrario, cuando se infundió un cóctel de esas hor-
monas más angiotensina II y vasopresina a voluntarios sanos se
observó el aumento de la actividad fibrinolítica y anticoagulante
(aumento de las concentraciones de fibrinógeno, t-PA y proteína C y
también de la actividad de las plaquetas). Estos resultados se refuer-
zan por los efectos anticoagulantes de una infusión de adrenalina que
comienza antes de la infusión de endotoxinas a individuos sano
s 50 .La anestesia regional, especialmente después de cirugía en la
parte inferior del cuerpo, provoca una hipercoagulabilidad menor
que la anestesia general y se asocia a menos trombosis venosas
profundas. La colecistectomía laparoscópica parece causar menos
estados de hipercoagulabilidad, mediante el incremento selectivo
del tPA, que la colecistectomía abierta.
El estado procoagulante acelera, a su vez, la respuesta infla-
matoria. La trombina, actuando a través de receptores activados
por la proteasa, estimula las citocinas (p. ej., la IL-6 y la IL-8 y la
proteína 1 quimiotáctica de los monocitos) y aumenta la expresión
de las moléculas de adhesión. El complejo de TF/factor VII aumenta
la respuesta inflamatoria de los macrófagos y neutrófilos, como se
demuestra por el aumento de las concentraciones plasmáticas de
IL-6 e IL-8 en la infusión del factor VII recombinante en individuos
sano
s 51. La inflamación más la trombosis microvascular parecen
ser responsables de la disfunción multiorgánica y, por tanto, justi-
fican el tratamiento con proteína C activada (APC) en la sepsis, un
tratamiento aprobado en esa indicación, mientras que los estudios
sobre TFPI y antitrombina III no tuvieron éxito.
Ayuno y malnutrición
El ayuno es consecuencia de respuestas adaptativas que permiten
que el cuerpo continúe funcionando a pesar de la ausencia de la
ingesta de nutriente
s 52 .Las reservas de glucógeno comienzan a
degradarse (glucogenólisis) durante las 24-48 horas siguientes a la
suspensión de la ingesta de nutrientes, para proporcionar glucosa
a los tejidos. Esta glucosa es fundamental para el cerebro, los eri-
trocitos, la piel y la médula renal, que tienen unos requerimientos
obligados de glucosa. La glucogenólisis está mediada por el
aumento de la relación de glucagón/insulina (aumento de glucagón
y descenso de insulina), que también favorece la producción endó-
gena de glucosa (gluconeogénesis). Además de aumentar el gluca-
gón y reducir la insulina, la hipoglucemia se evita por pequeños
incrementos de las catecolaminas y la secreción de cortiso
l 53 .El
incremento de la estimulación
b
-adrenérgica inducida por cateco-
laminas acelera la lipólisis, de manera que los triglicéridos almace-
nados en el tejido adiposo se degradan para liberar ácidos grasos
libres (AGL) y glicerol. Parte de los AGL sufren la conversión
hepática a cetonas (
b
-hidroxibutirato y acetoacetato), que se utili-
zan entonces como fuente de energía. A medida que se depleciona
el glucógeno la glucosa se obtiene en cantidades cada vez mayores
a partir de la gluconeogénesis, que proporciona más del 90% de la
glucosa después de 42 horas de ayun
o 54 .Entre los sustratos de
2698
Cuidados críticos
VII
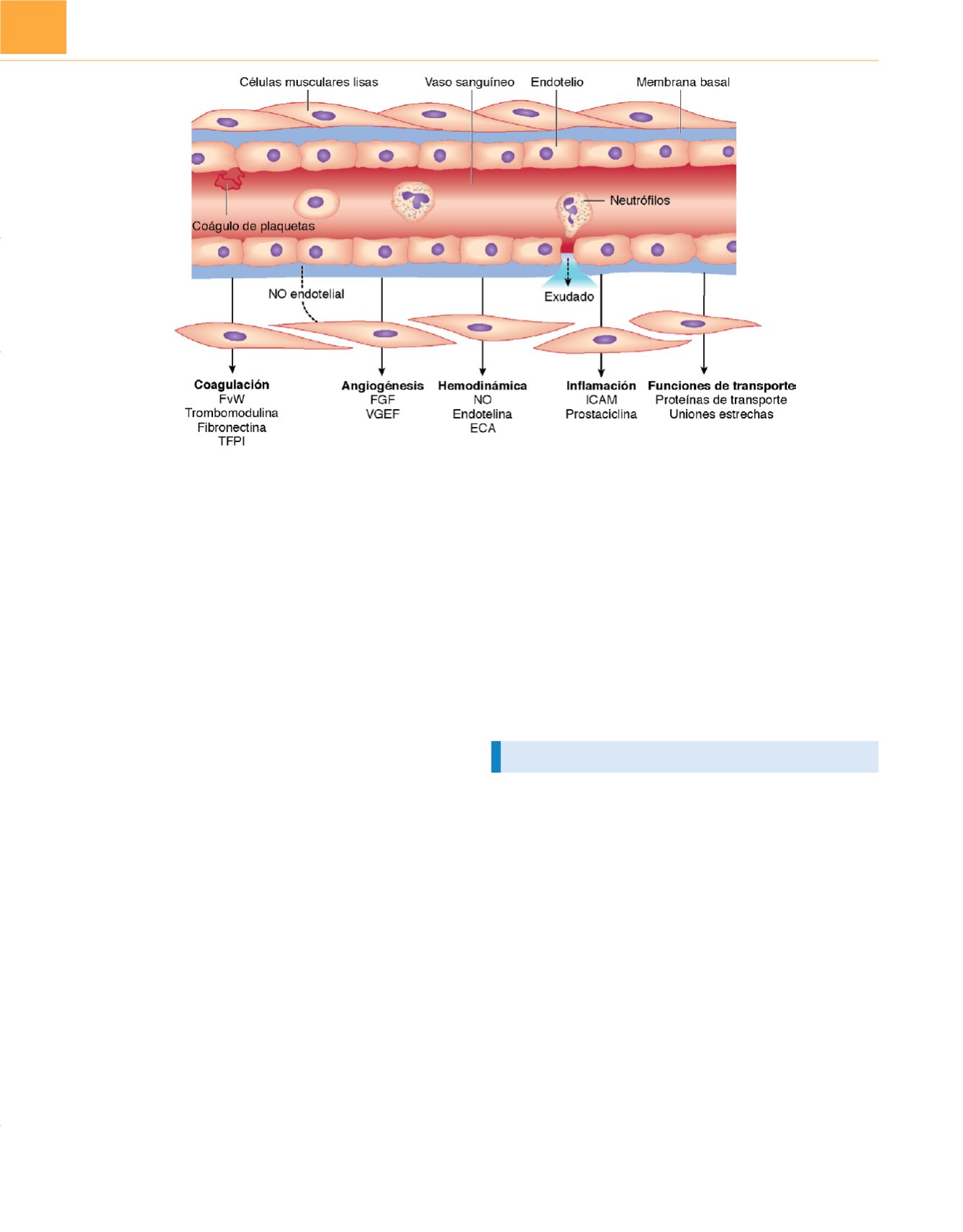
Figura 85-4
Las células endoteliales tienen muchas funciones. El óxido nítrico (NO) producido por las células endoteliales vasodilata los vasos sanguíneos
al relajar los miocitos adyacentes, mientras que la endotelina provoca vasoconstricción. El sistema NO-endotelina es el controlador local del tono vascular.
Durante la sepsis, las citocinas inflamatorias como el TNF regulan positivamente la sintasa del NO (iNOS), aumentando la producción endotelial de NO y
provocando vasodilatación. Durante la sepsis se producen alteraciones en el endotelio porque aumenta la expresión de moléculas de adhesión, lo que provoca
la adhesión de leucocitos y alteraciones en la membrana basal. En consecuencia, se produce exudación de líquido hacia el espacio extracelular. Las moléculas
de adhesión y las selectinas reclutan leucocitos para que entren en los tejidos. ECA, enzima convertidora de la angiotensina; FGF, factor de crecimiento de los
fibroblastos; FvW, factor von Willebrand; ICAM, molécula de adhesión intercelular; TFPI, inhibidor de la vía del factor tisular; VCAM, molécula de adhesión a
las células vasculares; VGEF, factor de crecimiento del endotelio vascular.









