
de carbohidratos inhibe la oxidación grasa, aumenta la oxidación
de la glucosa y favorece el almacenamiento de grasa. La lipogénesis
es poco importante cuantitativamente en el ser humano, ya que la
tasa de lipogénesis no es mayor que la tasa de oxidación lipídica.
A pesar de todo, cuando la ingesta de carbohidratos es mayor que
el gasto energético total la lipogénesis se convierte en una vía más
importante y los cocientes respiratorios (CR) pueden ser mayores
de 1,0, lo que indica la lipogénesis neta (v.
tabla 85-3 ). En los
pacientes muy graves que reciben glucosa por vía intravenosa en
dosis de 4mg/kg/min dentro de la nutrición parenteral total (NPT)
basada en glucosa se puede detectar un cierto incremento de la
lipogénesis hepática de novo a pesar de tener un CR de tan sólo
0,9
0 64 .Esta lipogénesis se produjo incluso cuando la capacidad
lipogénica pareciera estar disminuida en el estrés quirúrgico o por
sepsis. El descenso de la lipogénesis parece ser secundario a los
efectos del TNF que, entre otras funciones, puede inducir la apop-
tosis de los preadipocitos y los adipocitos. La IL-1
b
también puede
inhibir la lipogénesis en los adipocitos humanos.
Metabolismo lipídico
Las situaciones de estrés (p. ej., heridas, sepsis o insuficiencia car-
díaca congestiva) alteran el metabolismo lipídico. La modificación
más importante es la aceleración de la lipólisis debido al aumento
de estímulos
b
2
-adrenérgico
s 65 .La estimulación de los recepto
res
b
2
aumenta las concentraciones deAMPc, lo cual, a su vez, estimu-
la la actividad de la lipasa sensible a hormonas
( fig. 85-6). La respuesta
lipolítica a la estimulación
b
2
es mayor en los individuos delgados
que en los obesos. Los receptores
b
3
adrenérgicos también partici-
pan en la lipólisis en el ser humano. Las concentraciones más altas
de glucagón, TNF-
a
, IL-1, interferón-
a
e interferón-
g
también par-
ticipan estimulando la lipólisis. La resistencia a la insulina contri-
buye a la lipólisis porque se atenúa su efecto antilipolític
o 62 .Existen
variantes regionales en la tasa lipolítica, teniendo las células grasas
viscerales la mayor tasa como consecuencia del aumento de la
actividad de los receptores
b
2
y
b
3
y de la menor actividad de los
receptores
a
2
-adrenérgicos. La grasa subcutánea tiene menos acti-
vidad lipolítica, debido a la mayor actividad de los receptores de
insulina y de los receptores adrenérgicos
a
2
. El CR de los pacientes
heridos es sistemáticamente menor que en los individuos normales
para un nivel dado de ingesta, lo que indica una oxidación de grasa
mayor
( tabla 85-2 ). La infusión de glucosa en cantidades que pro-
vocan la síntesis neta de grasa en individuos normales no puede
suprimir la oxidación grasa en pacientes con heridas o sepsis, con
lo que el balance de grasa es negativo. Las concentraciones plasmá-
ticas de ácidos grasos libres son altas porque la tasa de lipólisis es
mayor que la de oxidación de la grasa.
La aceleración del metabolismo de glicerol y ácidos grasos
libres refleja la aceleración de la lipólisis que se ve durante el estrés.
El aumento de la lipólisis aumenta a su vez el aporte sistémico de
ácidos grasos circulantes libres (AGL). No obstante, los ritmos de
renovación son mayores de lo esperado ante el incremento de la
concentración plasmática de sus sustratos, lo que indica que aumen-
tan tanto la reesterificación de AGL a triglicéridos (TG) como la
lipólisis de TG a AGL. Este aumento de actividad del ciclo TG-AGL/
sustrato de glicerol parece ser una de las causas del hipermetabolismo
que se ve durante el estrés
( fig. 85-7). El bloqueo del receptor
b
-adre-
nérgico con propranolol disminuye la oxidación lipídica y el meta-
bolismo basal en reposo de los pacientes quemados. Las infusiones
de glucosa aumentan aún más la lipólisis durante la cirugía abdomi-
nal porque aumentan la actividad del sistema nervioso simpático.
En el estado de estrés aumenta la contribución relativa de la
oxidación de grasa al gasto energético en reposo, mientras que
disminuye la contribución de la oxidación de glucosa. Los AGL
liberados tras la lipólisis sufren
b
-oxidación, que en el paciente con
estrés es la vía predominante de producción de ATP (v.
figs. 85-5 y 85-6 ). Esta situación se comprueba, por ejemplo, después de la
esofagectomía, en la cual se determinó un descenso gradual de la
contribución de la oxidación de la grasa a la producción de energía,
con el aumento de la contribución de la oxidación de la glucosa a
medida que los pacientes entran en el período de convalecencia.
Metabolismo de proteínas
Uno de los principales pilares de la respuesta metabólica a la herida
y la sepsis es el catabolismo (balance negativo de nitrógeno). El
catabolismo se debe a la proteólisis acelerada del músculo esquelé-
tico, que proporciona parte del sustrato para cubrir el aumento de
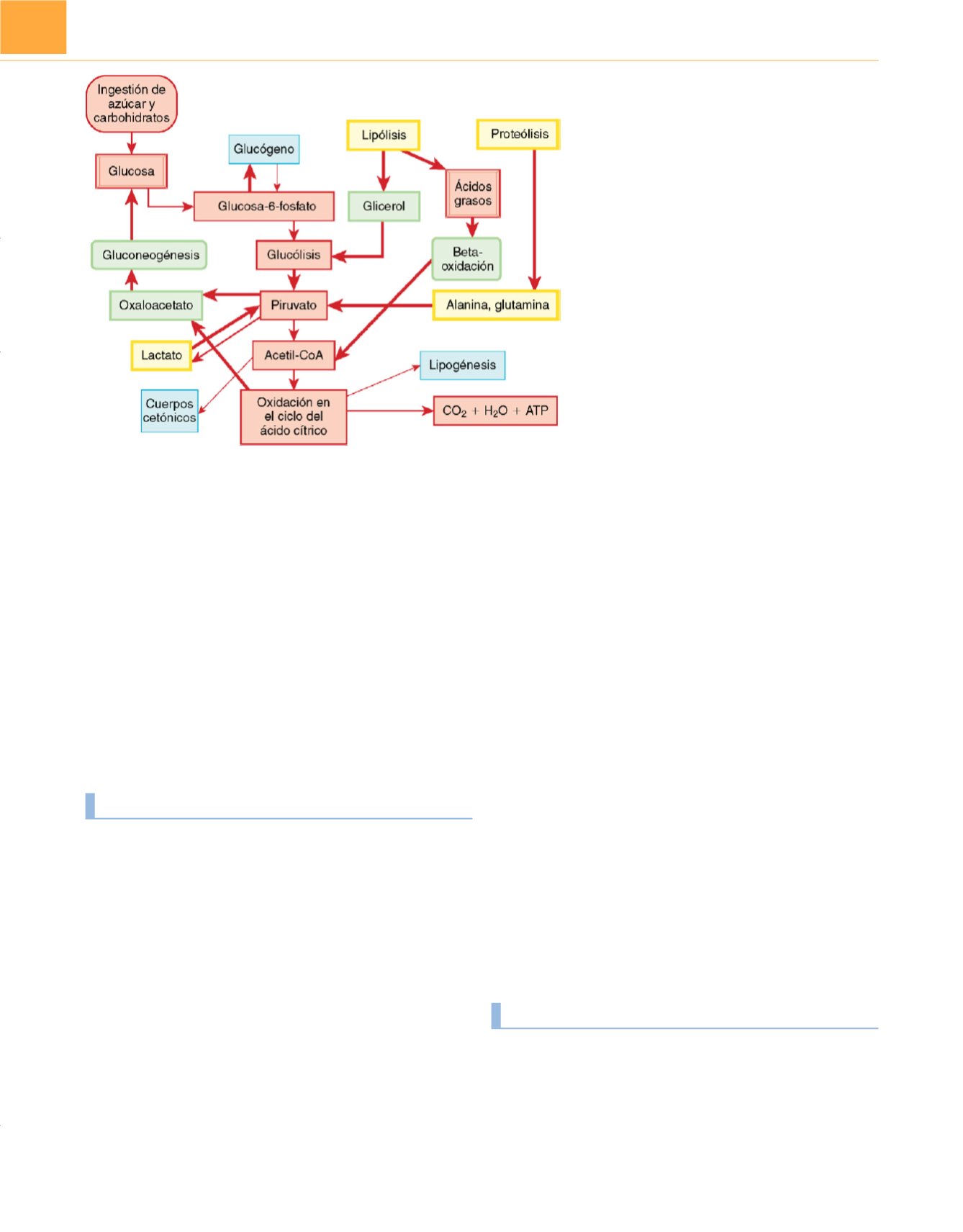
la gluconeogénesis hepática (v.
fig. 85-5). Cuando se reduce la tasa
de gluconeogénesis hepática con somatostatina no se consigue
2700
Cuidados críticos
VII
Figura 85-5
El medio metabólico durante el estrés.
La tasa de producción endógena de glucosa
(gluconeogénesis) está muy aumentada. Los sustratos son
el glicerol (por la lipólisis), la alanina (por la proteólisis) y el
lactato (de la herida). Debido a la resistencia a la insulina,
se usa menos glucosa para producir energía (ATP) y, por
tanto, la
b
-oxidación de los ácidos grasos se convierte en
la principal ruta de producción de energía. La ingestión de
glucosa exógena no disminuye la tasa de gluconeogénesis.
La producción de cetonas no está muy aumentada, debido
a las concentraciones normales o elevadas de insulina.
Acetil-CoA, acetil coenzima A; ATP, adenosina trifosfato.









