
Acoplamiento ventricular izquierdo-arterial
y rendimiento mecánico
La transmisión óptima del volumen sistólico desde el ventrículo
izquierdo a la circulación arterial necesita un ajuste adecuado de
estos sistemas mecánicos. El acoplamiento VI-arterial se ha des-
crito con frecuencia utilizando un modelo de cavidad elástica del
sistema cardiovascular. La elasticidad del VI en contracción (E
es
) y
de los vasos arteriales (E
a
) están determinadas por las relaciones
entre presión y volumen telesistólico del VI y entre presión arterial
telesistólica y volumen sistólico, respectivamente. El cociente entre
E
es
y E
a
define el acoplamiento entre el VI y la circulación arterial,
y es una técnica útil para valorar los efectos de fármacos, como los
anestésicos inhalatorios, en el ajuste entre el VI y las arterias in vivo.
El análisis de la relación entre presión y volumen proporciona un
marco para el estudio del rendimiento mecánico del VI, definido
por el cociente entre trabajo de eyección y área presión-volumen.
El acoplamiento VI-arterial teóricamente puede mantenerse
durante la anestesia, porque los descensos de la poscarga del VI
pueden equilibrar las reducciones simultáneas de la contractilidad
miocárdica. Concentraciones bajas de isoflurano (1 CAM), pero no
de halotano, mantenían E
es
/E
a
en perros sometidos a maniobras
experimentales agudas y anestesiados con barbitúricos, lo que con-
cuerda con la conservación del acoplamiento mecánico entre el VI
y la circulación arterial. Sin embargo, el isoflurano a 2 CAM dis-
minuía E
es
/E
a
, lo que indica que los efectos vasodilatadores de este
anestésico no eran capaces de compensar las disminuciones relati-
vamente mayores de la contractilidad. El desflurano, el sevoflurano
y el isoflurano mantenían un acoplamiento VI-arterial y un rendi-
miento mecánico óptimos cuando se valoraban con los cocientes
E
es
/E
a
y trabajo de eyección/área presión-volumen a concentracio-
nes anestésicas bajas (
<
0,9 CAM), mediante la producción de dis-
minuciones simultáneas de la contractilidad miocárdica y la
poscarga del V
I 1 .Sin embargo, el ajuste mecánico entre el ventrí-
culo izquierdo y las arterias y el rendimiento de la transmisión de
energía total del VI al trabajo sistólico externo, degeneran a con-
centraciones anestésicas más altas, lo que indica que la disminu-
ción de la contractilidad producida por anestésicos no se equilibra
adecuadamente con la reducción de la poscarga. El halotano (
<
1,0
CAM), pero no el isoflurano disminuyó la razón de fuerza hidráu-
lica oscilatoria y media in vivo, lo que indica que este anestésico
también reduce el rendimiento mecánico del VI. Los efectos per-
judiciales producidos por los anestésicos inhalatorios en el acopla-
miento VI-arterial contribuyen a la disminución del rendimiento
cardíaco global que se observa cuando se utilizan concentraciones
más altas de estos anestésicos in vivo.
Poscarga ventricular izquierda
Aunque la definición de poscarga del VI que describe las propie-
dades mecánicas de los vasos arteriales resistiendo a la eyección
del VI es fácil de entender, la evaluación cuantitativa de la poscarga
in vivo sigue siendo un problema cuya solución con frecuencia
confunde el concepto intuitivo clínico. La resistencia vascular sis-
témica, calculada como el cociente de la presión arterial media y el
volumen de eyección, es el que se utiliza con más frecuencia para
calcular la poscarga del VI. Sin embargo, la resistencia vascular
sistémica no describe adecuadamente esta poscarga, ya que este
índice no tiene en cuenta las características mecánicas de la sangre
y de las paredes arteriales, no valora la naturaleza fásica depen-
diente de la presión arterial y del flujo sanguíneo y no considera
los posibles efectos de la reflexión de la onda arterial. Por tanto, la
resistencia vascular sistémica no puede utilizarse de forma fiable
para medir los cambios producidos por fármacos como los anes-
tésicos inhalatorios o por las enfermedades cardiovasculares en la
poscarga del VI. La impedancia del gasto aórtico (Z
in
[
w
]) obtenida
por potencia espectral o series de análisis de Fourier de la presión
aórtica y de las ondas de flujo sanguíneo, proporciona una descrip-
ción exhaustiva de la poscarga del VI, puesto que Z
in
(
w
) incorpora
la viscoelasticidad arterial, la dependencia de la frecuencia y la
reflexión de la onda. Sin embargo, si se lleva a cabo el análisis de
Z
in
(
w
) en función de la frecuencia y no del tiempo, Z
in
(
w
) es muy
difícil de aplicar en la práctica clínica. Z
in
(
w
) suele interpretarse
utilizando un modelo de Windkessel de tres elementos de la circu-
lación arterial que describe la impedancia aórtica característica
(Z
c
), la distensibilidad arterial total (C) y la resistencia arterial total
(R). Z
c
representa la resistencia aórtica a la eyección del VI, C está
determinada sobre todo por la distensibilidad de la aorta y repre-
senta la parte de almacenamiento de energía de la circulación
arterial, y R iguala la resistencia combinada del resto de los vasos
Farmacología cardiovascular
365
13
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
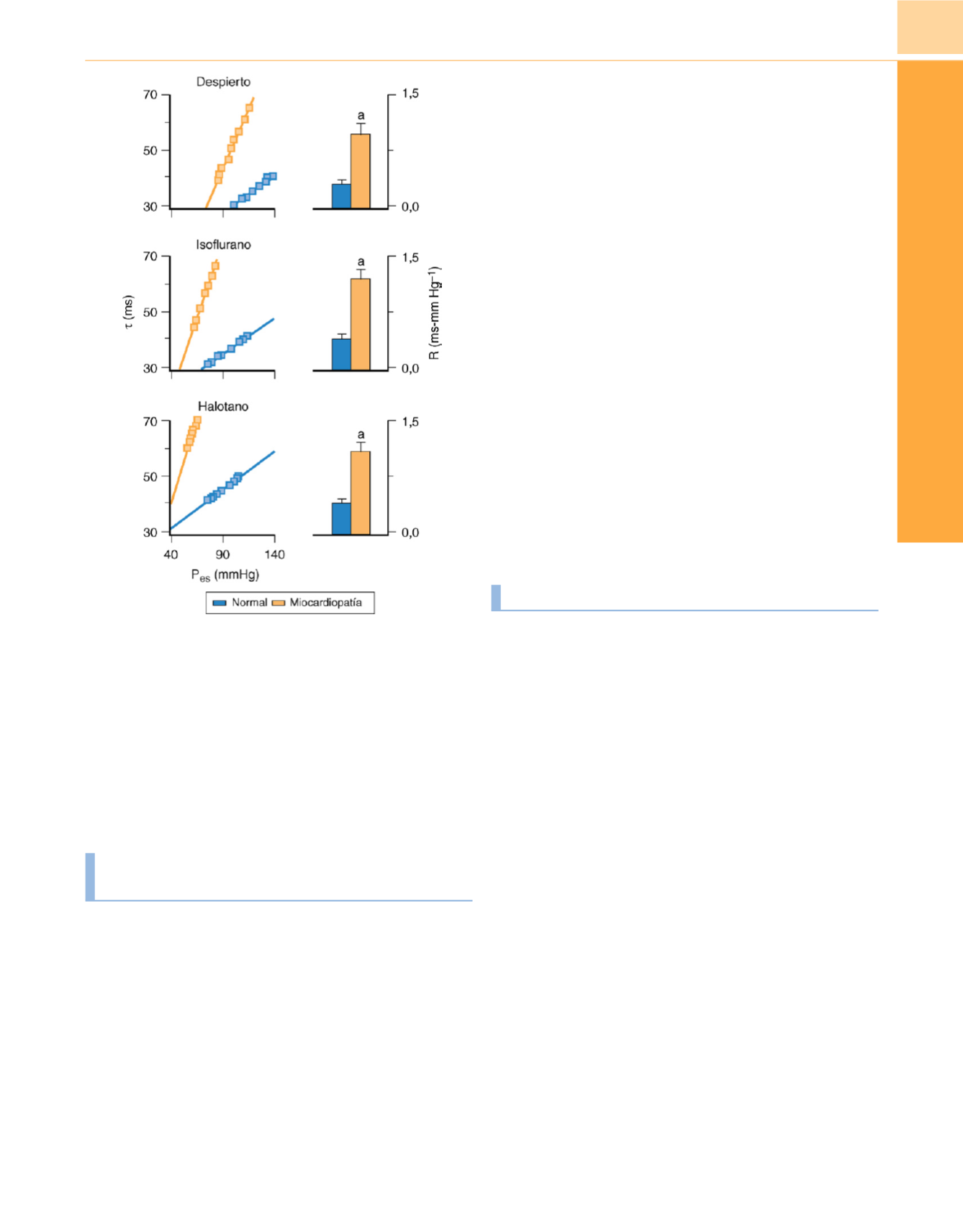
Figura 13-3
Relación lineal entre la constante de tiempo de la relajación
isovolumétrica (
τ
) y la presión telediastólica ventricular izquierda (P
es
) durante
la oclusión de la vena cava inferior
(izquierda)
en un perro normal, antes
(cuadrados amarillos)
y después
(cuadrados azules)
del desarrollo de una
miocardiopatía provocada por marcapasos, en animal despierto y durante la
anestesia con isoflurano y con halotano. Los histogramas de la
derecha
representan la pendiente (R) de la relación entre
τ
y P
es
en el animal despierto
(gráfico superior derecho)
y durante la anestesia con isoflurano
(gráfico
central derecho)
y halotano
(gráfico inferior derecho)
antes
(barras amarillas)
y después
(barras azules)
del estímulo con marcapasos. a, diferencia
significativa (
P
<
0,5) del miocardio normal.
(Adaptada de Pagel PS, Hettrick
DA, Kersten JR y cols.: Isoflurano and halotano do not alter the enhanced
afterload sensitivity of left ventricular relaxation in dogs with pacing-induced
cardiomyopathy.
Anesthesiology
87:952-962, 1997.)









