
celular en los miocitos cardíaco
s 184 .También se ha sugerido un papel
del receptor de la adenosina A
1
y de la proteincinasa C en el efecto
cardioprotector de los opioide
s 185,186. Todavía tiene que demostrarse
por medio de ensayos clínicos si los resultados experimentales que
muestran un efecto protector de los opioides en la isquemia miocár-
dica se traducen en una reducción en la morbilidad y la mortalidad
en pacientes con enfermedad de las arterias coronaria
s 187. Dosis altas
de opioides pueden mantener la perfusión miocárdica y la relación
entre la demanda y el aporte de O
2
, de la misma manera o mejor que
técnicas basadas en fármacos inhalatorio
s 188,189.
Circulación coronaria
No parece que los opioides tengan efectos significativos en la
función vasomotora coronaria ni en el metabolismo miocárdico;
no producen fenómenos de robo y no reducen la capacidad de las
arteriolas coronarias grandes de responder a los fármacos vasoac-
tivo
s 190 .La conductividad coronaria está regulada por el control
barorreflejo arterial, y se induce una respuesta vasodilatadora ante
un aumento de la presión aórtica. Este control barorreflejo aumenta
con concentraciones plasmáticas bajas de fentanilo (1 a 2ng/ml),
pero posiblemente se inhibe con concentraciones crecientes del
mismo fármac
o 191 .En un estudio sobre los efectos de los opioides
y los moduladores neuroendocrinos en arterias coronarias porci-
nas, el fentanilo (a diferencia del sufentanilo y la morfina) antago-
nizaba las contracciones inducidas por la acetilcolin
a 192 .El efecto
del fentanilo no era reversible con naloxona, por lo que se pensó
que se debía a un efecto directo sobre el músculo liso.
Reflejos circulatorios
En un experimento en el que se exploraban las respuestas del reflejo
barorreceptor inducidas por la perfusión del seno carotídeo a niveles
predeterminados, las dosis moderadas de fentanilo preservaban bien
los reflejos barorreceptores, mientras que las dosis altas del mismo
fármaco producían una depresión de los reflejos del barorrecepto
r 193.
El reflejo oculocardíaco, producido por la tracción de los músculos
extraoculares durante la cirugía de estrabismo, aumentaba de forma
significativa con fentanilo,sufentanilo y remifentanil
o 194.Prácticamente
todos los pacientes pediátricos sometidos a cirugía de estrabismo y
anestesiados con propofol (12mg/kg/h) y alfentanilo (0,04mg/kg/h)
desarrollaron un reflejo oculocardíaco, y se observó que eran frecuen-
tes las alteraciones del ritmo auriculoventricula
r 195.
Liberación de histamina
La morfina produce liberación de histamina y activación simpatico-
suprarrenal. La codeína y la meperidina inducen la activación de las
células cebadas con la liberación de histamina, probablemente a
través de un mecanismo diferente al de los receptores opioides
m 196.
El aumento en la histamina plasmática tras la administra-
ción de morfina provoca una dilatación de las arteriolas terminales
y efectos cardíacos directos cronotrópicos e inotrópicos positivos.
Los cambios cardiovasculares que induce la morfina son similares
cuando se pretrata a los pacientes con difenhidramina (un antago-
nista de los receptores histamínicos H
1
) o con cimetidina (un anta-
gonista de los receptores histamínicos H
2
). Sin embargo, en enfermos
tratados con antagonistas de los receptores histamínicos H
1
y H
2
,
las respuestas cardiovasculares aparecen muy atenuadas, a pesar de
que se producen aumentos similares en la concentración de hista-
mina plasmática. La meperidina también causa liberación de his-
tamina con mayor frecuencia que la mayoría de los opioides. Al
contrario que la morfina y la meperidina, el fentanilo, el alfentanilo
y el remifentanilo no incrementan la histamina plasmática; además,
con estos opioides, la hipotensión es menos frecuente.
Mecanismos vasculares
Se ha definido farmacológicamente un nuevo subtipo de receptor
opioide, denominado
m
3
, que es sensible a los alcaloides opioides y
no responde a los péptidos opioides, incluidos péptidos que habían
mostrado previamente tener afinidad por los receptores opioides
m
.
Este receptor se expresa en células endoteliales humanas y está
acoplado a la vasodilatación mediante la producción de óxido
nítrico. Es posible que, al menos parcialmente, la vasodilatación
inducida por la morfina esté producida por la activación del recep-
tor
m
3 197. Estudios farmacológicos que han evaluado el alfentanilo,
el fentanilo y el sufentanilo en perros prueban la existencia de una
relajación del músculo liso vascular por un mecanismo periférico
direct
o 198. La medida del flujo sanguíneo en el antebrazo tras la
infusión de sufentanilo en la arteria braquial indica que el sufenta-
nilo posee un efecto vasodilatador directo sobre el tejido vascular
humano que es, probablemente, independiente de un mecanismo
neurogénico o sistémic
o 199. Una dosis supraclínica de alfentanilo
atenúa la contracción inducida por fenilefrina mediante un efecto
inhibidor del flujo de calcio al bloquear los canales de calcio del
tipo L en el tejido liso vascular de la aorta de la rat
a 200. El remifen-
tanilo puede producir alteraciones transitorias en las variables
hemodinámicas. Sin embargo, estos cambios no son únicamente el
resultado de la inhibición autonómica o del SNC o de la estimula-
ción vagal mediada centralmente. En un estudio farmacológico en
el que se utilizaron anillos de aorta torácica de ratas se observó que
la vasodilatación causada por el remifentanilo se produce por un
mecanismo dependiente del endotelio que implica la liberación de
prostaciclina y de óxido nítrico por el endotelio, así como por meca-
nismos independientes del endotelio, probablemente mediados por
la inhibición de canales de Ca
2+
sensibles a voltaj
e 201.
Los opioides pueden tener efectos sobre la vascularización
pulmonar, al igual que sobre la circulación sistémica. Recientemente
se ha demostrado que la contracción inducida por la fenilefrina de
la arteria pulmonar canina está mediada fundamentalmente por la
552
Farmacología y anestesia
II
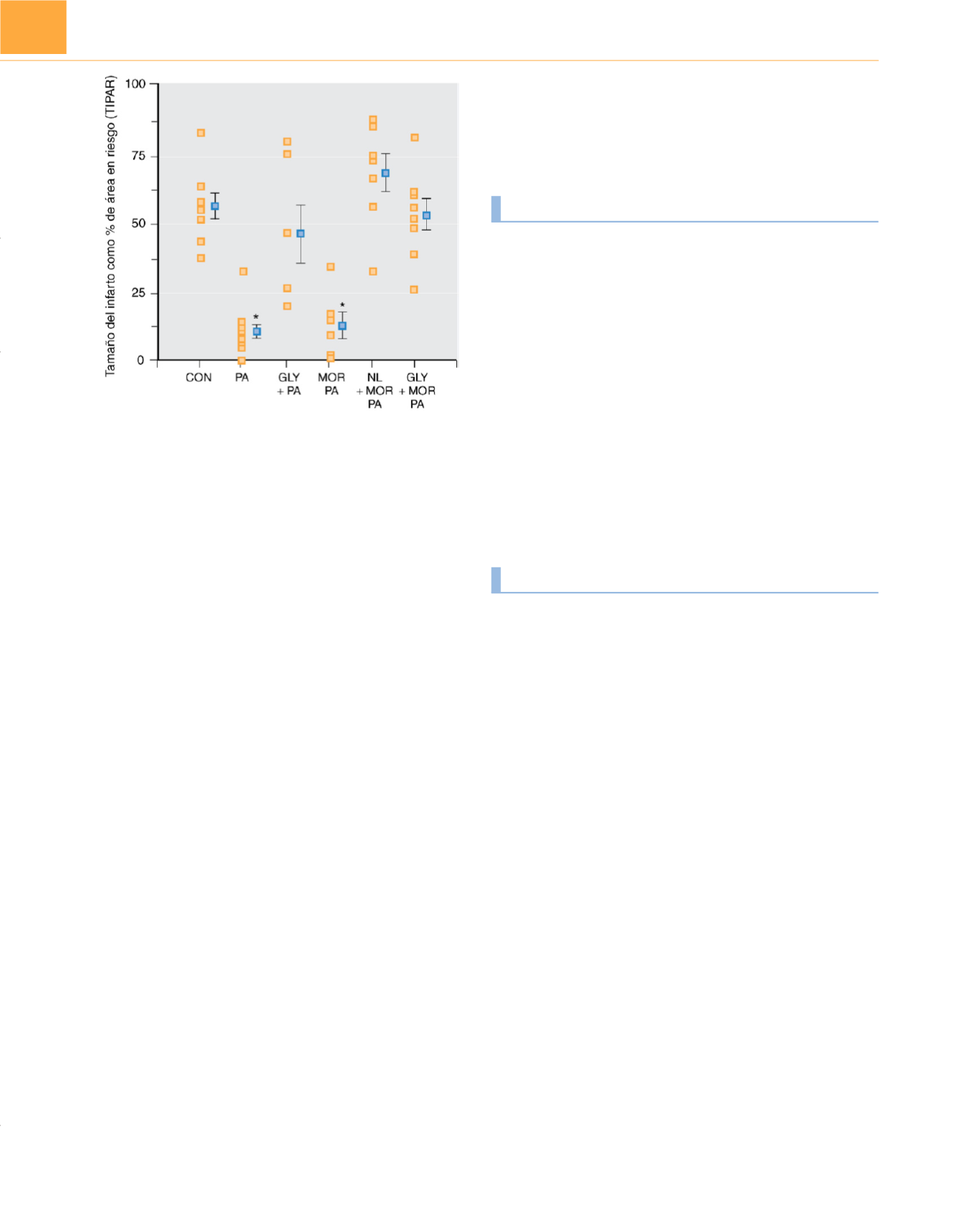
Figura 17-10
Tamaño del infarto en corazón de rata en condiciones control
(CON), preacondicionamiento isquémico (PA), glibenclamida (0,3mg/kg i.v.)
administrada 30 minutos antes del PA isquémico (GLY+PA), PA inducido con
morfina (3×100
m
g/kg, 5 minutos de infusión i.v.) (MOR PA), naloxona (3mg/kg
i.v.) administrada 10 minutos antes del PA inducido con morfina (NL+MOR PA)
y glibenclamida (0,3mg/kg i.v.) administrada 30 minutos antes del PA inducido
con morfina (GLY+MOR PA).
(De Schultz JE, Hsu AK, Gross GJ: Morphine mimics
the cardioprotective effect of ischemic preconditioning via a glibenclamide-
sensitive mechanism in the rat heart
. Circ Res
78; 1100-1104, 1996.)









