
un aparentemente alto volumen de distribución en el equilibrio
estacionario. Como se distribuyen de manera amplia y rápida a
distintos tejidos corporales, la redistribución tiene un fuerte
impacto en la disminución de la concentración de opioides, sobre
todo en el período precoz tras la inyección. La
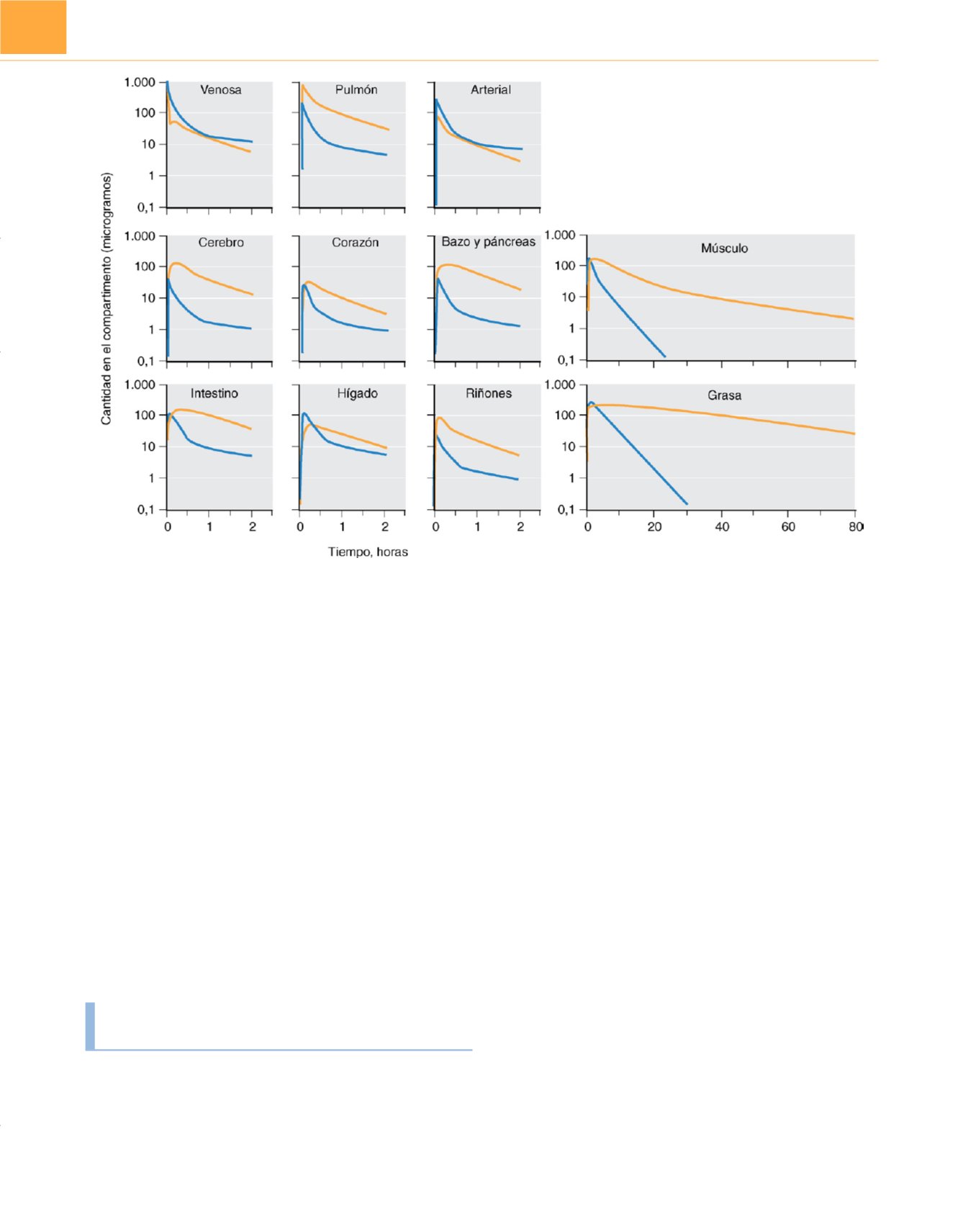
figura 17-12muestra
una simulación mediante ordenador de los opioides en varios
órganos. Las diferencias entre las propiedades fisicoquímicas del
fentanilo y el alfentanilo producen una marcada diferencia global
en su disposición. La distribución en músculo y grasa es amplia y
disminuye lentamente debido a su baja vascularización.
La captación de opioides por el pulmón tiene una gran impli-
cación en la farmacocinética de los mismos. El tiempo necesario
para alcanzar la máxima concentración de un opioide está influido
por el porcentaje de captación pulmonar. La captación pulmonar
de fentanilo es mayor que la de alfentanilo, lo que se explicaría por
la diferencia en el secuestro en las células endoteliales pulmonares.
La captación pulmonar de opioides puede afectar a la farmacociné-
tica de otros fármacos. En gatos se ha demostrado que la adminis-
tración de fentanilo 30 segundos antes de la inyección de propofol
reduce la captación pulmonar de este último fármaco.
Características farmacocinéticas
particulares de algunos opioides
Morfina
La farmacocinética de la morfina es muy distinta de la de los
congéneres del fentanilo. Las diferencias se deben, en gran parte,
a que la morfina es, en comparación, menos liposoluble. Existe
una captación de morfina por el pulmón en menor cuantía durante
el primer paso.
La p
K
a
de la morfina (8,0) es mayor que el pH fisiológico, y,
por tanto, después de una inyección intravenosa, sólo una pequeña
fracción (10-20%) se encuentra no ionizada. La entrada al cerebro
y la salida de éste de la morfina son, al parecer, más lentas que las
de otros opioides. Alrededor del 20-40% de la morfina se halla
unida a proteínas plasmáticas, en especial a la albúmina.
La morfina se metaboliza sobre todo mediante conjugación
en el hígado, aunque el riñón desempeña una función primordial
en el metabolismo extrahepático de dicho fármaco. La morfina-3-
glucurónido (M3G) es el principal metabolito de la morfina, pero
no se une al receptor opioide y posee un escaso efecto analgésico.
La M3G puede antagonizar de forma aguda a la morfina, lo que
podría contribuir a la variabilidad en la respuesta y a la resistencia
al efecto analgésico de esta última. La M6G constituye aproxima-
damente el 10% de los metabolitos de la morfina, y es un agonista
del receptor
m
más potente que la morfina, con una duración del
efecto similar a ésta. Se sabe que la M6G contribuye de forma
significativa al efecto analgésico de la morfina, incluso en pacientes
con una función renal normal. En concreto, en enfermos con insu-
ficiencia renal, la acumulación de M6G puede producir una mayor
incidencia de efectos secundarios, como depresión respiratoria. Un
trabajo reciente sugería que el polimorfismo en un solo nucleótido
en el receptor opioide
m
influía en la susceptibilidad a la toxicidad
de los opioides relacionados con la M6G. La proporción de extrac-
ción hepática de la morfina es alta, por lo que la biodisponibilidad
de morfina que se administra por vía oral es mucho menor
(20-30%) que tras la administración intramuscular o subcutánea.
Al parecer, la M6G es uno de los principales compuestos activos
558
Farmacología y anestesia
II
Figura 17-12
Simulaciones informáticas de las concentraciones de fentanilo
(líneas amarillas)
y de alfentanilo
(líneas azules)
en varios órganos y tejidos en un sujeto
humano de 70kg tras la inyección intravenosa de un bolo de 1mg de cada uno de los dos fármacos.
(De Bjorkman S, Stanski DR, Verotta D, Harashima H: Comparative
tissue concentration profiles of fentanyl and alfentanil in humans predicted from tissue/blood partition data obtained in rats
. Anesthesiology
72:865-873, 1990.)









