
Anestésicos locales
687
20
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
La tasa de unión específica y las afinidades por las diferentes
conformaciones del canal de sodio dependen del tipo de anestésico
local. Las características moleculares del sitio de unión del anesté-
sico local se comprenden mejor cuando los detalles de esta depen-
dencia se relacionan con las propiedades fisicoquímicas del fármaco
y con las condiciones experimentales.
Características del punto de unión
del anestésico local
La mutación intencionada de aminoácidos específicos del canal
de Na
+
ha permitido definir qué regiones del mismo interactúan
directamente con los anestésicos locales. La proteína funcional más
importante del canal de Na
+
(la subunidad-
a
) se compone de cuatro
«dominios» homólogos (DI a DIV), cada uno de los cuales contiene
seis regiones helicoidales (S1 a S6) que atraviesan el centro de la
membrana
( fig. 20-9 A). Por su parte, cada dominio posee un bucle
denominado «región P», que conecta las terminaciones extracelula-
res de sus segmentos S5 y S6. Las regiones P se extienden hacia el
interior entre las regiones transmembrana, de modo que cuando las
subunidades-
a
se pliegan juntas, cada bucle P contribuye a la forma
ción de un cuarto del cilindro que actúa como «poro selectivo» iónico, el punto de paso más estrecho en un canal abierto (v.
fig. 20-9 B).
La sensibilidad al voltaje deriva de los segmentos S4 cargados posi-
tivamente que se deslizan o giran «hacia fuera» en respuesta a la
despolarización de la membrana. El movimiento de los segmentos
S4, por conexiones aún desconocidas, se traduce en una nueva dis-
posición de los segmentos S6, que acaban formando la entrada cito-
plasmática interna del canal. El movimiento de los segmentos S6
cierra a modo de compuertas el canal abierto, mientras que la unión
del bucle citoplasmático entre D-3 y D-4 con la apertura citoplasmá-
tica del canal da lugar a la inactivación de la compuerta.
Los anestésicos locales se unen al «vestíbulo interno» del canal
deNa
+
(v.
fig.20-9 C).Lasmutaciones de los aminoácidos de los segmen
tos S6 de D-1, D-3 y D-4 modifican la acción de los anestésicos locales,
lo que indica que estas regiones pueden formar un «farmacoforo» lo suficientemente pequeño como para contactar de manera simultánea
con la molécula del fármaco en las tres superficies o que la molécula
del anestésico local se mueve con rapidez entre estos tres segmentos.
La tasa de unión constante de los anestésicos locales a los
canales de Na
+
cerrados es más elevada para las moléculas más hidro-
fóbicas, lo que indica que las moléculas del fármaco pueden alcanzar
la zona de unión (y abandonarla) a través de una ruta «hidrofóbica».
Esta ruta podría consistir en el movimiento lateral de la fase de la
membrana, hacia el canal, o a través de los restos de aminoácidos
hidrofóbicos que limitan el acceso a través del poro cerrado. La len-
titud del bloqueo de los canales inactivados y cerrados parece emplear
dicha ruta hidrofóbica, responsable de la inhibición tónica.
Las formas cargadas de los anestésicos locales se disocian
mucho más despacio de los canales de Na
+
cerrados e inactivados
que las formas neutras, lo que sugiere que puede participar una
unión iónica en la unión del fármaco o que la molécula cargada se
mueve solo lentamente a lo largo de la vía hidrofóbica.
En suma, las propiedades hidrofóbicas favorecen la llegada
del fármaco al receptor, y la carga lo retiene en el mismo.
Aspectos neurofisiológicos
de la inhibición fásica
Los distintos tipos de fibras de un nervio se ven afectados de
manera diferente durante la anestesia local. Esa diferencia se debe
en parte a factores farmacocinéticos. En particular, durante la fase
inicial y durante la fase de recuperación del bloqueo clínico, la
difusión longitudinal y radial del fármaco hace que la concentra-
ción del anestésico en el interior del nervio y a lo largo del mismo
varíe. Esa variación se suma a la inhibición dinámica dependiente
del uso para dar lugar a una propagación variable que depende de
la geometría de la fibra, de su posición en el interior del nervio y
de las propiedades electrofisiológicas y funcionales.
Los distintos tipos de fibras también presentan diferencias en
cuanto a la sensibilidad al bloqueo por parte de los anestésicos locales.
Los experimentos efectuados in vivo en los que se equilibran los anes-
tésicos locales mediante la infusión continua de los nervios periféricos,
así como los experimentos que emplean inyecciones en bolo percutá-
neas similares a la anestesia clínica de un nervio periférico, muestran
de modo inequívoco que los axones mielinizados de pequeño calibre
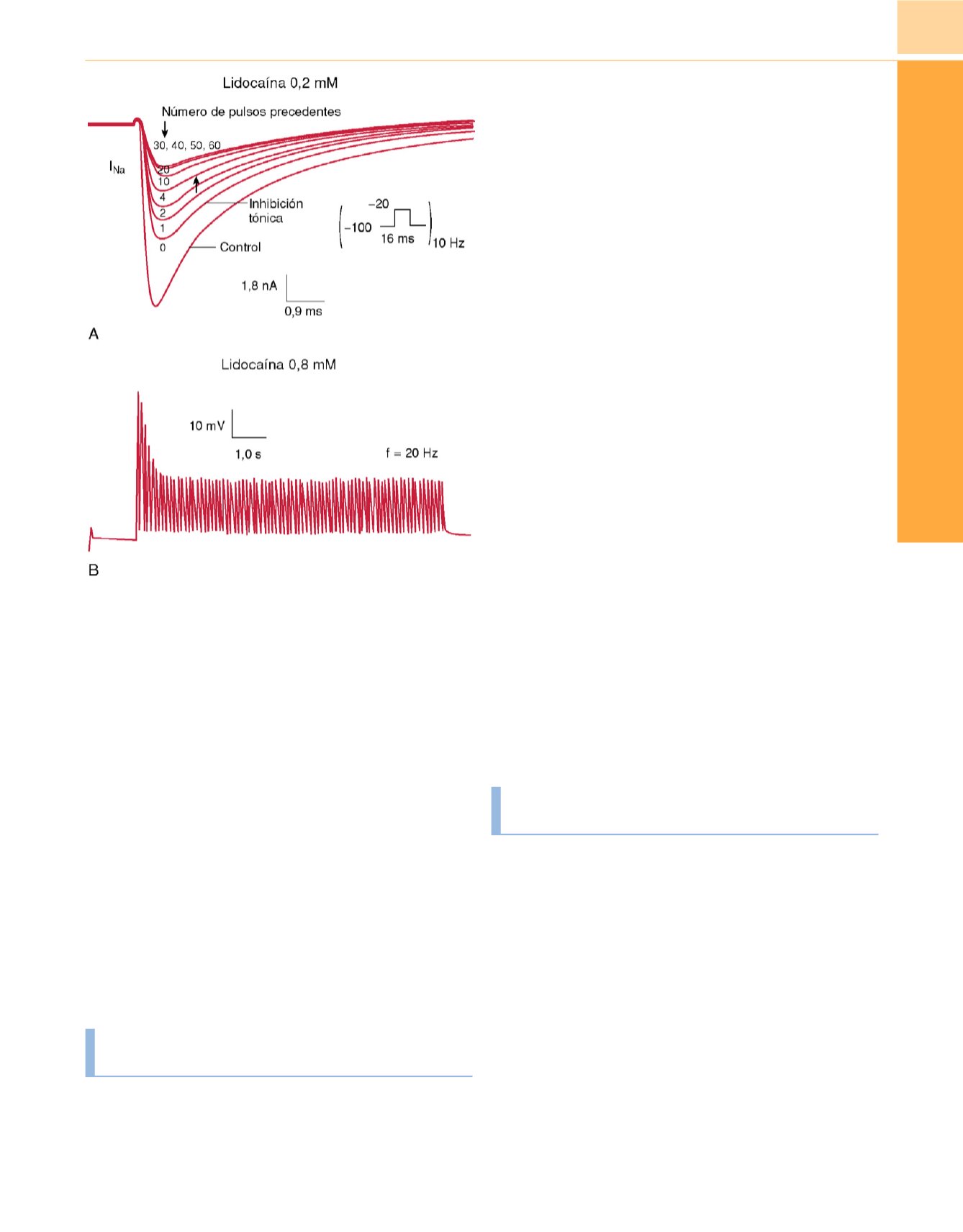
Figura 20-8
Acciones «dependientes del uso» de los anestésicos locales
sobre las propiedades de las membranas excitables.
A,
Las corrientes iónicas
de Na
+
medidas mediante técnicas de fijación de voltaje se ven activadas
transitoriamente tras la aplicación infrecuente de estímulos despolarizantes
(prueba «tónica») o en sucesiones de 10 veces por segundo (prueba «fásica»,
véanse los valores de la Em entre paréntesis). Tras la exposición a lidocaína
0,2mM (0,005%), las corrientes tónicas se reducen un 30% respecto de las
corrientes controles. La aplicación de la serie de despolarizaciones «fásicas»
se acompaña de una reducción dinámica de las corrientes tras cada
despolarización; durante la serie se alcanza un valor continuo de inhibición
fásica en el 75% de las corrientes controles. La recuperación de las corrientes
a su valor tónico tiene lugar a los pocos segundos de cesar la prueba fásica
(resultados no mostrados).
B,
Los anestésicos locales también inhiben los
potenciales de acción de una manera fásica. Tras equilibrar con lidocaína
0,8mM (0,02%), el potencial de acción se reduce de modo tónico
aproximadamente un 20% de la amplitud que posee en una solución libre
del fármaco (datos no mostrados). La estimulación mediante una serie de 20
estímulos por segundo induce una inhibición fásica, que disminuye aún más la
amplitud hasta un 70% de los valores observados en los controles. Al igual que
ocurre con las corrientes iónicas
(A),
la inhibición fásica de los potenciales de
acción se recupera con rapidez cuando cesa la estimulación de alta frecuencia.









