
688
Farmacología y anestesia
II
(fibras sensitivas A
d
y fibras motoras A
g
) son los más susceptibles a la
supresión del estímulo. En segundo lugar se encuentran las fibras
mielinizadas demayor calibre (A
a
yA
b
); y por último,las fibrasmenos
susceptibles son las fibras C, de pequeño calibre y no mielinizadas. De
hecho, en este último grupo, los impulsos de la población de fibras de
conducción más lenta (velocidad de conducción = 0,5-0,8 ms) son los
más resistentes a la acción de los anestésicos locale
s 18 .Por tanto, la
creencia generalizada de que los anestésicos locales bloquean primero
o principalmente las fibras de menor calibre es claramente errónea.
Sensibilidad selectiva de las isoformas de los canales de Na
+
Desde un punto de vista fisiológico se han identificado diez canales
de Na
+
diferentes, cuya secuencia bioquímica ha sido descifrada.
Al menos cuatro de ellos se encuentran en las neuronas periféricas,
algunos asociados de manera exclusiva con las aferencias nocicep-
tivas. Es evidente que desde el punto de vista clínico sería prove-
choso inhibir de forma selectiva estos canales para reducir o
eliminar el dolor sin afectar otras funciones. Aunque el bloqueo
selectivo de los canales ha sido conseguido con toxinas naturales
de tipo peptídico de pequeño tamañ
o 19 ,se ha descrito un bloqueo
relativamente poco selectivo de los anestésicos locale
s 20, probable-
mente porque el farmacoforo del anestésico local es demasiado
parecido entre las diferentes isoformas de los canales y las molécu-
las de anestésico local poseen varios ejes de rotación, lo que hace
que sean malos moldes estructurales para seleccionar entre los
lugares de unión estáticos.
I
soformas
de
los
canales
de
sodio
en
enfermeda
-
des
humanas
caracterizadas
por
dolor
o
insensibilidad
al
dolor
.
Las mutaciones en la isoforma Na
V
1.7 del canal de sodio
pueden producir enfermedades que cursen con dolor espontáne
o 21,22o alteraciones profundas y selectivas en la sensibilidad al dolo
r 23. La
eritromialgia se caracteriza por episodios de dolor urente grave,
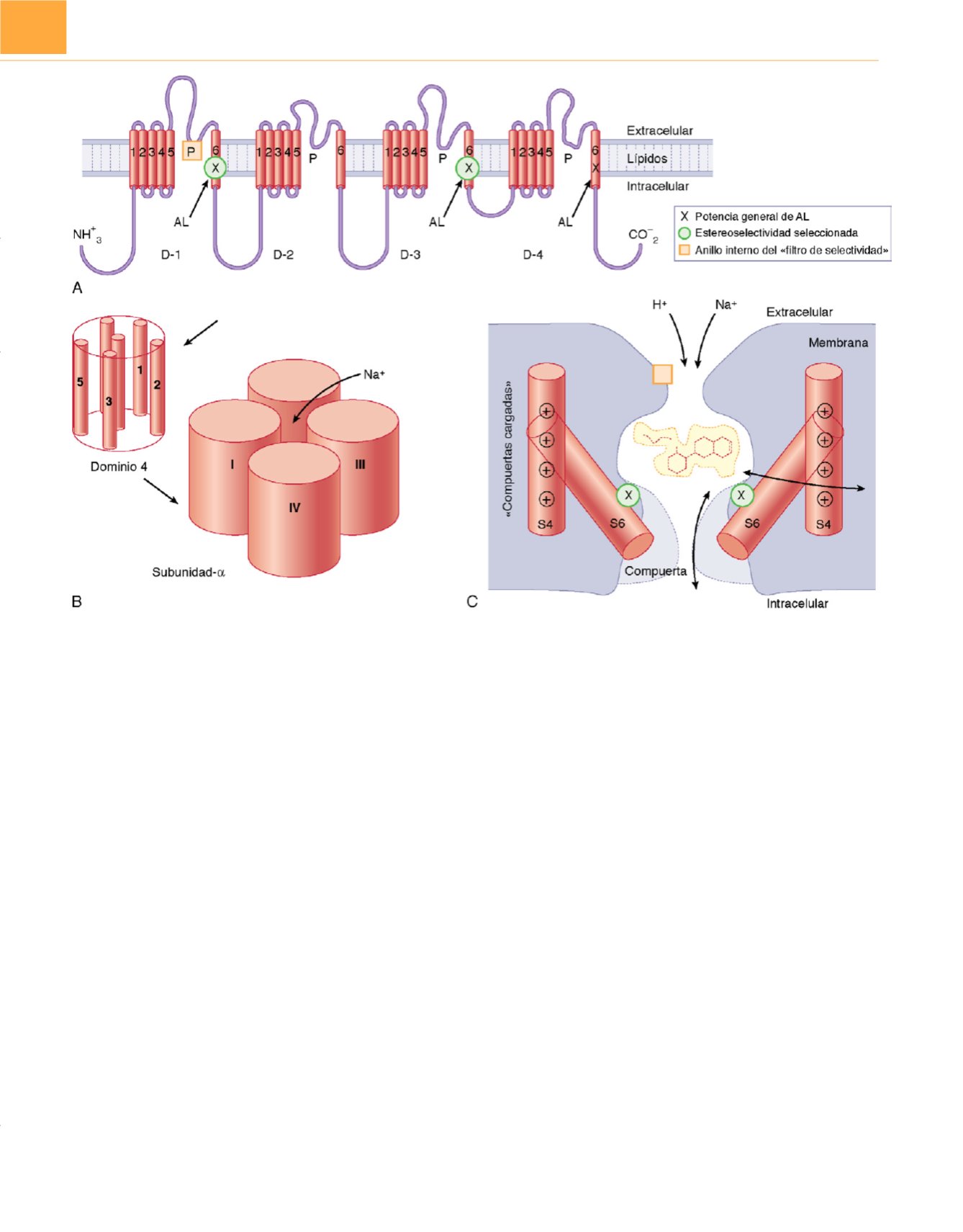
Figura 20-9
Características estructurales del canal de Na
+
que determinan las interacciones con los anestésicos locales (AL).
A,
Disposición del péptido único
de la subunidad-
a
del canal de Na
+
en una membrana plasmática. Se compone de cuatro dominios con secuencias homólogas (D-1 a D-4), cada una de las cuales
contiene seis segmentos
a
-helicoidales que atraviesan la membrana (S1 a S6). Cada dominio se pliega en sí mismo originando un haz cilíndrico de segmentos.
Estos haces convergen para formar la estructura cuaternaria del canal funcional
(B).
La activación que conduce a la apertura del canal se debe al movimiento
primario de los segmentos S4 cargados positivamente en respuesta a la despolarización de la membrana (v. gráfico
C
). La unión en el extremo citoplasmático
del canal de una parte del pequeño bucle que conecta D-3 a D-4 se traduce en la rápida inactivación del canal. Los iones que atraviesan un canal abierto lo
hacen a través de un poro definido en su punto más estrecho por la región P, consistente en la penetración parcial en la membrana de los cuatro bucles de
proteínas extracelulares que conectan S5 y S6 en cada dominio. El estudio de las mutaciones intencionadas y dirigidas de diferentes aminoácidos del canal
indican qué residuos están implicados en la fijación del AL en el vestíbulo interno del canal (X, en los segmentos S6) y en las regiones interiores del filtro selectivo
discriminativo de iones (
cuadrado,
en la región P), y también se sabe que influyen en la estereoselectividad de la inhibición fásica (
círculo,
también en los
segmentos S6).
C,
Sección transversal esquemática del canal en la que se especula sobre la manera en la que los segmentos S6, que forman una «compuerta»,
pueden realinearse durante la activación para abrir el canal y permitir la entrada y salida de una molécula de bupivacaína por la ruta «hidrofílica». La asociación
del AL con el canal cerrado (inactivado) es más íntima, de modo que la ruta favorita para su disociación ya no se encuentra entre los segmentos S6 (el poro
inicial), sino que ahora, de manera mucho más lenta, se emplea la ruta «hidrofóbica», lateralmente entre los segmentos, y a través de la membrana. Los iones de
Na
+
que se introducen por el poro compiten con el AL por un sitio en el canal, y los iones de H
+
, que pasan muy despacio a través del poro, pueden entrar y salir
por la apertura extracelular, protonando y desprotonando una molécula de AL y regulando de este modo su ritmo de disociación del canal.









