
realizar un ensayo clínico más amplio con sangre fresc
a 53. Pienso
que la sangre fresca también contiene factores sin identificar que
la hacen mucho más eficaz que los hemoderivados.
Determinar los niveles plasmáticos de fibrinógeno es útil,
porque este factor de coagulación no disminuye en la sangre de
banco. Si su nivel in vivo es bajo (
<
150mg/dl), no se debe a una
coagulopatía por dilución y es muy sugerente de CID o de un sín-
drome similar a CID. La CID es probable en el caso de trombocito-
penia, hipofibrinogenemia y lisis de un coágulo en 2 hora
s 48 .Por
desgracia, los niveles de fibrinógeno en los concentrados de hematíes
disminuyen cuando aumenta el tiempo de almacenamiento. Como
resultado, cuando se administran múltiples concentrados de hema-
tíes aparece hipofibrinogenemia por un mecanismo de dilució
n 54 .El ácido
ε
-aminocaproico (AEAC) inhibe la formación de
plasmina y atenúa la fibrinólisis. Esta sustancia no debe usarse para
tratar la CID. Si se bloquea la fibrinólisis y se tiene activado el
sistema de la coagulación, aparecerá una trombosis diseminada.
Como la fibrinólisis primaria es infrecuente, salvo en la prostatec-
tomía y el trasplante hepátic
o 55 (v. cap. 46 ),no debería adminis-
trarse AEAC a menos que se establezca con claridad el diagnóstico
previo tras una consulta especializada. A pesar de todas las reco-
mendaciones anteriores, en ocasiones la hemorragia persiste debido
a una coagulopatía asociada a transfusión. En la actualidad existe
una nueva estrategia. La administración de factor VII activado
recombinante (fVIIar) ha tenido éxito en el tratamiento de dichas
coagulopatías de forma intraoperatoria. La mayoría de estos
pacientes suelen asociar otras enfermedades, como pancreatitis
necrosante, cirrosis o traumatismos graves. Este producto tan espe-
ranzador es muy caro y debe ser visto como un tratamiento de
rescate, hasta que la aprobación de la FDA esté más fundamen-
tad
a 56 (v. cap. 46 para más detalles).
Fármacos empleados para mejorar
la hemostasia
Además del AEAC, se han recomendado otros tres fármacos para
los problemas perioperatorios de la coagulació
n 57 .Dos de ellos han
sido objeto de una atención especial. El primero es la 1-desamino-
8-d-arginina vasopresina (DDAVP), un análogo sintético de la
hormona antidiurética vasopresina. Esta sustancia aumenta los
niveles de los factores VIII y von Willebrand, por lo que es un
tratamiento bien establecido para la hemofilia y la enfermedad de
von Willebrand. También reduce la pérdida de sangre y las necesi-
dades de transfusión en pacientes con coagulación preoperatoria
normal que van a ser sometidos a una cirugía cardíaca o espinal.
Sin embargo, aún está por determinar el papel final de la DDAV
P 57 .Este fármaco puede provocar hipotensión, hiponatremia y aumento
de la adhesión plaquetaria.
Otro de los fármacos es la aprotinina, un inhibidor de la
serinproteasa que impide la fibrinólisis y mejora la función plaque-
taria. Se ha utilizado para disminuir las pérdidas de sangre en
múltiples procedimientos quirúrgicos, como en la circulación
extracorpórea. Sin embargo, aún no se ha establecido su lugar
definitivo en el tratamiento de las coagulopatías.
El tercer fármaco es el ácido tranexámico, que es también un
antifibrinolítico. En dos estudios se halló una menor hemorragia
en la artroplastia total de rodilla. Es de suponer que al retirar el
torniquete neumático se libera material fibrinolítico, que se inhibe
por el ácido tranexámico.
Un gran metaanálisis en el que se evaluó el uso periopera-
torio de la transfusión de sangre como factor pronóstico en
cirugía cardíaca concluyó que la aprotinina y el ácido tranexá-
mico, pero no la desmopresina, disminuían las transfusiones de
sangre alogénica de forma perioperatori
a 58. Aún está por definir
el uso final de estos fármacos.
Diagnóstico y tratamiento de la diátesis
hemorrágica después de la transfusión
de concentrados de hematíes
Al contener mucho menos plasma, el uso de concentrados de
hematíes puede provocar una mayor dilución de ciertos paráme-
tros de la coagulación que el uso de sangre completa. Murray y
cols
. 54estudiaron la cuestión específica del uso de concentrados de
hematíes para las hemorragias abundantes. En líneas generales las
alteraciones de la coagulación fueron similares a las observadas con
la sangre completa, pero con una excepción principal. Al usar
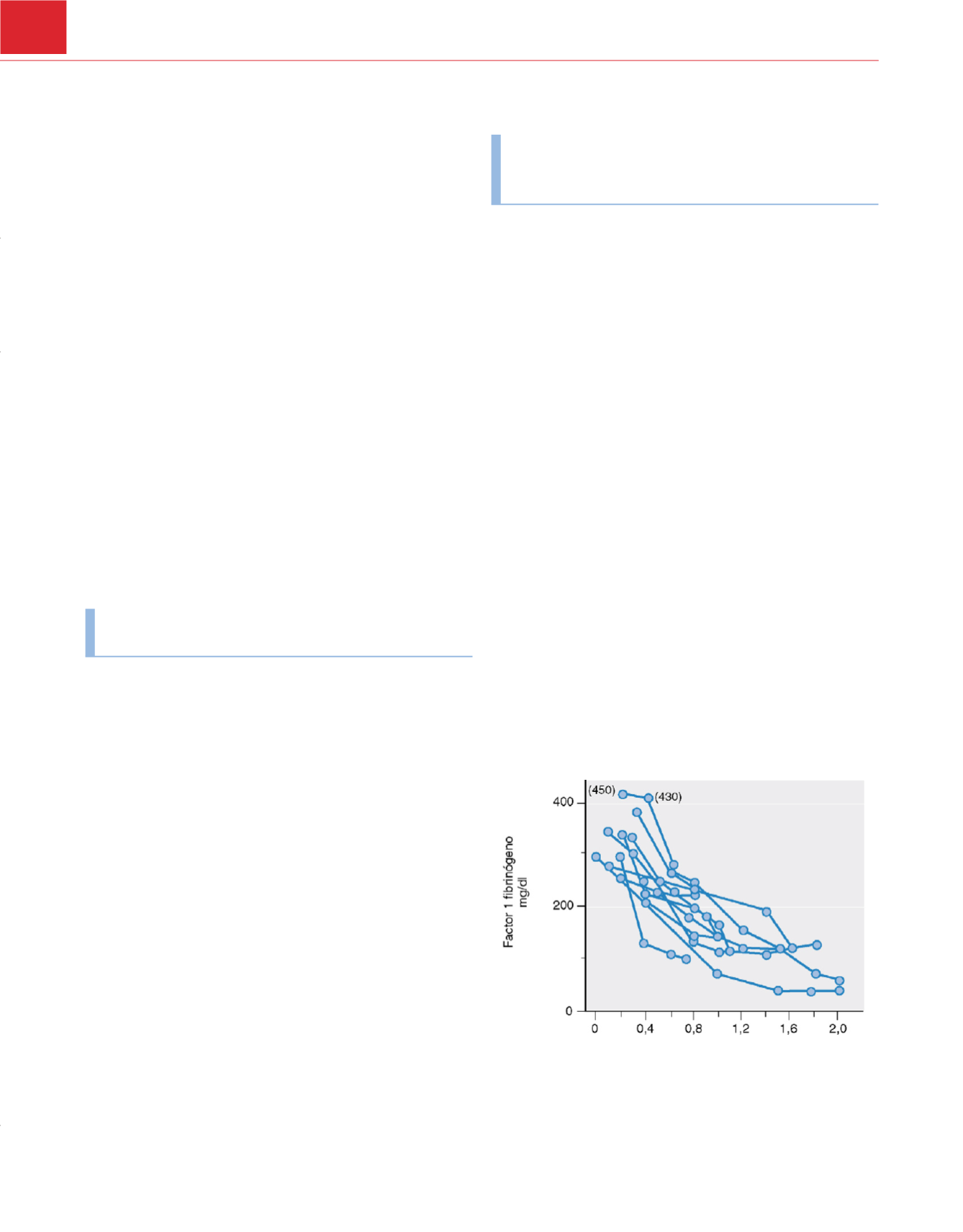
concentrados de hematíes, los niveles de fibrinógeno disminuían
de forma significativa, al contrario de lo que ocurría cuando se
empleaba sangre completa, en cuyo caso, se mantenían si no había
CID
( fig. 45-6 ). Aunque todos los factores de la coagulación dis-
minuían, el descenso era menor al esperado por dilución. La
opinión de los investigadores es que tal vez se almacenan factores
como el VIII en las células endoteliales y se liberan del endotelio
durante el estrés quirúrgico. Cuando se usan concentrados de
hematíes para reemplazar una hemorragia cuantiosa, el médico
puede tener la tentación de administrar PFC de forma profiláctica.
Sin embargo, Murray y cols
. 54recomiendan de modo específico no
hacerlo. Estos autores afirman que el PFC es necesario sólo cuando
el tiempo de protrombina y el de tromboplastina parcial son al
menos 1,5 veces el valor de referencia y los niveles de fibrinógeno
son menores de 75mg/dl. Estas recomendaciones son similares a
las establecidas en el apartado «Plasma fresco congelado». Leslie y
To
y 59proporcionan unas recomendaciones más específicas para el
uso de concentrados de hematíes en transfusiones masivas. Para
estos autores, cuando se han transfundido 12 unidades o más de
concentrados de hematíes o de sangre de recuperador, son necesa-
rios factores de coagulación (es decir, PFC). Los pacientes que
reciben 20 unidades o más suelen necesitar transfusión de plaque-
tas, al igual que los que reciben sangre completa.
La
figura 45-7muestra un algoritmo para la evaluación y el
tratamiento inicial del paciente con sospecha de coagulopatía.
1516
Control de la anestesia
III
Figura 45-6
Descenso de la concentración de fibrinógeno a medida que se
reemplaza el volumen sanguíneo mediante concentrados de hematíes en AS-1
y cristaloides. Cada paciente está representado como una línea continua
.
(De Murray DJ, Olson J, Strauss R, Tinker JH: Coagulation changes during packed
red cell replacement of major blood loss.
Anesthesiology
69:839, 1988.)









