
reumática es una causa menos frecuente de EA, y suele asociarse
con IA concomitante.
M
anejo
anestésico
.
La premedicación puede aliviar la
ansiedad del paciente en relación con la cirugía cardíaca, y ayuda
a prevenir la taquicardia perioperatoria en los pacientes con EA.
La monitorización de estos pacientes incluye modalidades están-
dar no invasivas y la monitorización invasiva de la presión sanguí-
nea y PVC. Dependiendo del grado de la EA, el trazado de la vía
arterial puede mostrar algunos cambios típicos. La presión de
pulso puede ser tan baja como 50mmHg o menos. La pendiente
ascendente del trazado se retrasa y tiene una prominente muesca
anacrótica, que ocurre a un nivel inferior a medida que aumenta
el grado de la EA, mientras que la muesca dicrótica se reduce en
tamaño o incluso desaparece a medida que va progresando
la enfermedad. Puede considerarse la inserción de un catéter en la
AP para la monitorización de la PAP y del gasto cardíaco durante
la cirugía y sobre todo en el período postoperatorio. Casi siempre
es deseable una sonda de ETE si no hay contraindicaciones para
su colocación.
El manejo anestésico de los pacientes con EA gira alrededor
de evitar fluctuaciones en la hemodinámica del paciente mientras
se logra una profundidad anestésica adecuada. La inducción de la
anestesia no debe implicar medicación alguna que pudiera tener
efectos inotrópicos negativos o vasodilatadores. También se debe
evitar cualquier agente que pudiera causar taquicardia. Además, se
debe hacer todo lo posible para asegurarse de que el paciente per-
manece en ritmo sinusal. En los pacientes con EA, la contracción
auricular puede contribuir hasta con el 40% del total del gasto
cardíac
o 345 .Por consiguiente, para tratar cualquier posible arritmia,
se deben considerar los electrodos externos de cardioversión, pre-
feriblemente antes de la inducción de la anestesia.
Por último, es importante darse cuenta de que la presencia
de EA grave reduce la utilidad de la reanimación cardiopulmonar
(RCP) para mantener un gasto cardíaco suficiente para satisfacer
las necesidades fisiológicas del paciente. La
tabla 50-13resume los
objetivos de los cuidados anestésicos de un paciente con EA.
Insuficiencia aórtica
F
isiopatología
.
La IA es el flujo de sangre desde la aorta
en sentido retrógrado, hacia el ventrículo izquierdo durante la fase
diastólica del ciclo cardíaco. Se ha observado que la prevalencia
global de la IA es del 1% en los varones y del 13% en las mujeres
en el Framingham Offspring Stud
y 346 .La IA crónica es más preva-
lente y comporta un pronóstico mucho mejor que la IA aguda. Sin
embargo, sigue siendo desconocida la prevalencia precisa de la IA,
tanto aguda como crónic
a 347 .La IA crónica y la aguda tienen, cada una de ellas, su propia
etiología. Las causas de la IA crónica incluyen lesiones congénitas,
procesos degenerativos y enfermedad reumática, pero las causas
idiopáticas parecen ser las más comune
s 347 .Estos procesos produ-
cen una mala coaptación de las valvas de la válvula aórtica al causar
anomalías en las propias valvas o dilatación del anillo valvular
aórtico, la raíz aórtica, o ambo
s 347 .Las anomalías de las valvas de la válvula aórtica incluyen
afecciones congénitas (p. ej., válvula aórtica bicúspide), endocardi-
tis, enfermedad reumática, enfermedades inflamatorias, ciertas
enfermedades del tejido conjuntivo, y traumatismo de la pared
torácica que causa lesión en una valva de la válvula aórtica. La
dilatación de la raíz aórtica proximal puede estar causada por
ectasia anuloaórtica consecuencia de hipertensión crónica de larga
duración o simplemente por el proceso de envejecimiento normal.
Otras causas anulares de la válvula aórtica o de la raíz aórtica que
producen IA son: síndrome de Marfan, sífilis, enfermedades del
tejido conjuntivo, enfermedades congénitas tales como osteogéne-
sis imperfecta y el síndrome de Ehlers-Danlos, así como causas
idiopáticas.
I
nsuficiencia
aórtica
crónica
.
Los pacientes con IA
crónica pueden permanecer asintomáticos durante años e incluso
décadas. El ventrículo izquierdo sufre un proceso de remodelación
causado por replicaciones en serie de sarcómeros y desarrollo de
hipertrofia ventricular excéntrica y de aumento del tamaño cavitario
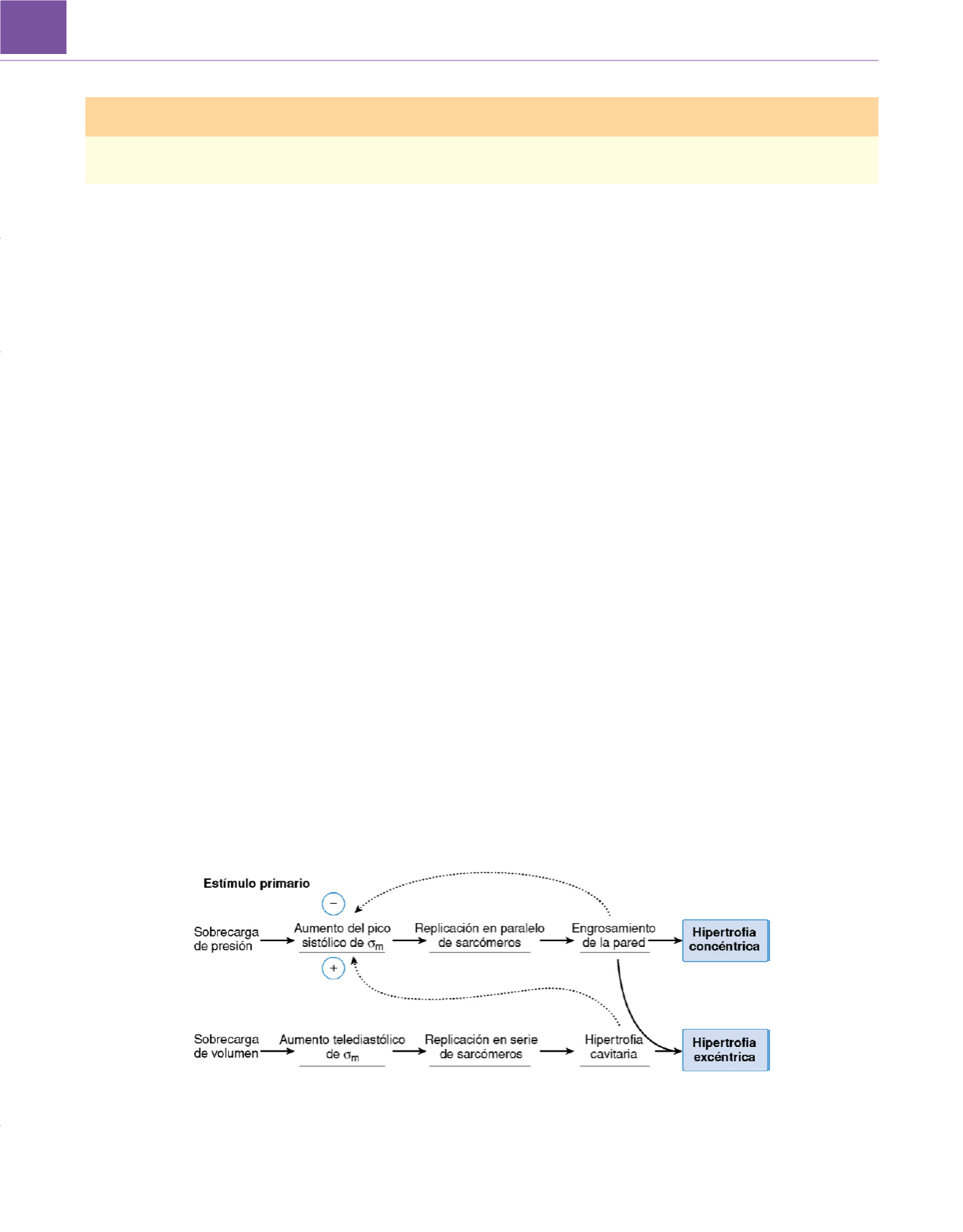
ante un volumen cada vez mayor de reflujo
( fig. 50-26 ) 348. Aunque
el bucle de presión volumen está muy desplazado a la derecha en
1700
Anestesia por subespecialidades en el adulto
IV
Figura 50-26
El mayor pico sistólico de estrés parietal resultante de la sobrecarga de presión crónica estimula directamente la hipertrofia ventricular
concéntrica, que tiende a contrarrestar o «normalizar» el elevado estrés de la pared ventricular.
(De Grossman W, Jones D, Mclaurin LP: Wall stress and pattern
of hypertrophy in the human left ventricle.
J Clin Invest
56:56, 1975.)
Tabla 50-13
Objetivos de los cuidados anestésicos en los pacientes con estenosis aórtica e insuficiencia aórtica
Precarga ventricular
izquierda
Frecuencia cardíaca Estado contráctil
Resistencia vascular
sistémica
Reflujo vascular
pulmonar
Estenosis aórtica
↑
↓
(sinusal)
Mantener
↑
Mantener
Insuficiencia aórtica
↑
↑
Mantener
↓
Mantener
De Sukernik MR, Martin DE: Anesthetic management for the surgical treatment of valvular heart diseases.
En
Hensley FA, Martin DE, Gravlee GP (eds.):
A Practical
Approach to Cardiac Anesthesia,
4.ª ed. Filadelfia, Lippincott Williams & Wilkins, 2008, págs. 316-347.









