
Observe que en la
figura 9-22el efecto «basal» en ausencia del
fármaco es el 20% del efecto, porque algunos receptores están
en estado activado. Sólo en presencia del agonista inverso casi
todos los receptores se ven forzados al estado inactivado, reve-
lando así la respuesta fisiológica en ausencia completa de acti-
vación del receptor.
E
stados
del
receptor
.
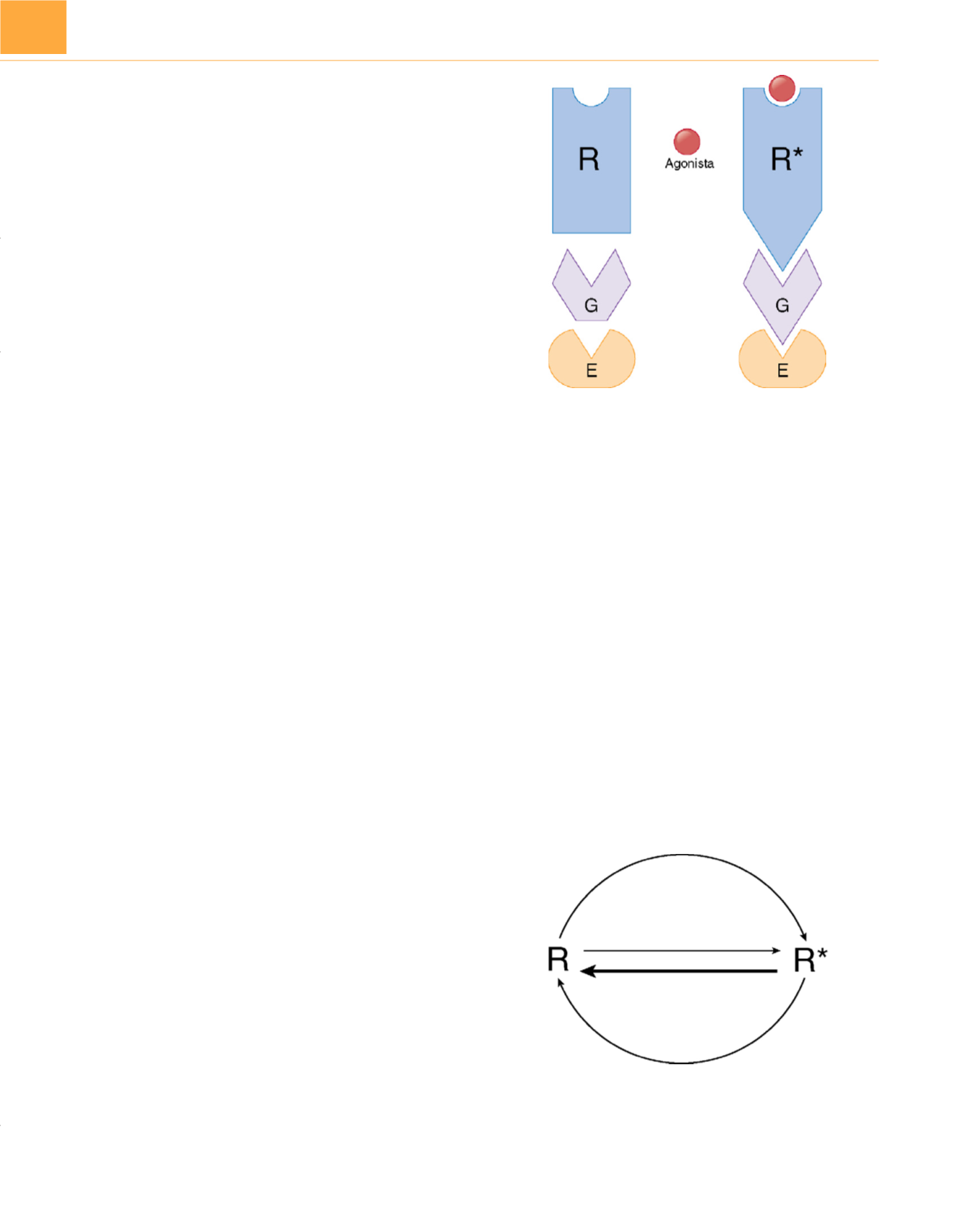
La teoría clásica del receptor
describe la interacción entre ligando y receptor según las leyes
de acción de masas. A nivel molecular, esta interacción ha sido
interpretada durante años para indicar que la unión del ago-
nista al receptor provoca un cambio en la conformación del
receptor que pasa de un estado inactivo (R) a otro activado (R*)
( fig. 9-24 ). En este modelo el cambio de conformación del
receptor facilita el acoplamiento del receptor activado a proteí-
nas intermediarias (p. ej., proteínas nucleótido guanina [G]) o
a segundos mensajeros (efectores, E), que después inician una
cascada rápida de respuestas celulares.
Experimentos en animales transgénicos han aportado infor-
mación útil sobre las interacciones entre ligando y receptor. En un
conjunto de experimentos se provocó una sobreexpresión masiva
de receptores
b
2
-adrenérgicos (
b
2
-AR) en miocardio de rató
n 11 .Se
observó un aumento de las respuestas de segundo mensajero en
ausencia de ligando en comparación con el miocardio de ratón
normal. De hecho, la actividad adenilciclasa (segundo mensajero
estudiado con más frecuencia para los
b
2
-AR) era idéntica en
estado basal en animales transgénicos (en ausencia de fármaco)
que en ratones normales estimulados con isoproterenol (agonista
de los
b
2
-AR). Además, la estimulación con isoproterenol de ani-
males transgénicos no aumentó la actividad adenilciclasa por
encima de este nivel basal elevado. Este hallazgo indica que en estos
animales transgénicos hay una subpoblación de receptores ya acti-
vados por completo.
Estos hallazgos implican que en estado basal existe de forma
espontánea un pequeño porcentaje de receptores en estado acti-
vado (R*). Dado que algunos receptores están normalmente acti-
vados, la actividad de estos receptores R* forma parte del efecto
basal observado en ausencia de fármaco. No obstante, tras una
sobreexpresión masiva de
b
2
-AR en un animal transgénico, este
porcentaje del total de receptores se convierte en un número muy
elevado de receptores activados. Esto imita el efecto de una dosis
máxima de agonista, que produciría un número similar de recep-
tores en estado R*.
Estos hallazgos tienen importantes implicaciones para
conocer los estados de los receptores y las interacciones fármaco-
receptor. En lugar de que la unión al ligando produzca un cambio
del estado R al R* (como sugiere la
fig. 9-24), estos datos señalan
una conversión espontánea del estado R a R*
( fig. 9-25). El efecto
del ligando es estabilizar el estado R*, lo que aumenta el porcen-
taje de receptores activados. En la mayoría de los tejidos, la con-
centración de R* representa un pequeño porcentaje de la
población total de receptores (de ahí la flecha gruesa que apunta
a R en la
fig. 9-25 ). Este hallazgo explica la acción de los agonistas
inversos como fármacos que estabilizan R, reducen el número de
receptores en estado activado y disminuyen la respuesta fisioló-
gica por debajo del nivel «basal clínico». También indica que
existe un «nivel basal verdadero», que es el estado clínico en
ausencia completa de receptores activados. Las principales dife-
rencias entre «basal clínico» y «basal verdadero» tendrían lugar
probablemente en los tejidos con las concentraciones más altas
de R* espontáneo. Por tanto, los agonistas inversos podrían ser
más eficaces en dichos tejidos.
La
figura 9-23 Dmuestra un tejido, el sistema nervioso
central (SNC), con suficientes canales iónicos regulados por
ligando (R*) activados por ácido
g
-aminobutírico tipo A
(GABA
A
) como para observar cambios electroencefalográficos
con un agonista inverso. En última instancia, es importante
observar que la explicación asume sólo dos estados del receptor:
R (completamente inactivo) y R* (completamente activado).
Puede haber varios estados de transición entre R y R* (de ahí el
uso de líneas curvas además de líneas rectas en la
fig. 9-25). Sin
embargo, para simplificar, la exposición que sigue sólo emplea
R y R*.
Como se ve en la
figura 9-26, los agonistas estabilizan
(o favorecen energéticamente) el estado R*, retirando así el
receptor del equilibrio instantáneo con R y conduciendo (por
acción de masas) más receptores hacia R*
( fig. 9-27 ). Por tanto,
la probabilidad de estar en estado R* aumenta en presencia de
un agonista. Los agonistas inversos desplazan la ecuación hacia
la izquierda, estabilizando la configuración R. Los antagonistas
neutros se unen por igual a R y R*, evitando la unión del ago-
nista sin alterar el equilibrio entre R y R*. Por tanto, los anta-
gonistas neutros no cambian la respuesta basal observada
(v.
fig. 9-22).
264
Farmacología y anestesia
II
Figura 9-24
Diagrama esquemático de la activación clásica del receptor.
Durante años se pensó que la unión del ligando hace que los receptores
pasen de un estado inactivo (R) a un estado activado (R*). Después, el
receptor activado interacciona con las proteínas nucleótido de guanina (G)
intermediarias o directamente con las cascadas de segundo mensajero
(efectores, E) o con ambos. Los hallazgos más recientes indican un equilibrio
más complicado entre R y R* como se muestra en las
figuras 9-25 a 9-27 .Figura 9-25
Conversión espontánea de receptores de estado inactivo (R) a
activo (R*). En la mayoría de los tejidos, R* es un pequeño porcentaje de la
población total de receptores.









