
Receptores acoplados a proteína nucleótido guanina (G)
Uno de los métodos más frecuentes por el que los receptores de
membrana convierten la ocupación por agonista en una «acción»
intracelular es mediante proteínas G intermediarias. Los recep-
tores acoplados a proteína G son el tipo de receptor más abun-
dante conocido. La
figura 9-29muestra de modo esquemático la
estructura global de un receptor acoplado a proteína G. Esta
representación bidimensional revela un grupo aminoterminal
extracelular con sitios de glucosilación, un grupo carboxilo ter-
minal intracelular, un enlace a ácido graso (habitualmente
mediante palmitoilación o miristoilación de un residuo de cis-
teína carboxiterminal), tres bucles extracelulares y cuatro bucles
intracelulares. Los sitios principales de interacción de la proteína
G con el receptor se localizan en el tercero y cuarto (y en menor
grado en el segundo) bucle intracelular, mientras que los princi-
pales sitios de fosforilación (correlacionados a menudo con des-
ensibilización [o atenuación de las respuestas del receptor])
están habitualmente en el tercer bucle intracelular y en el grupo
carboxiterminal.
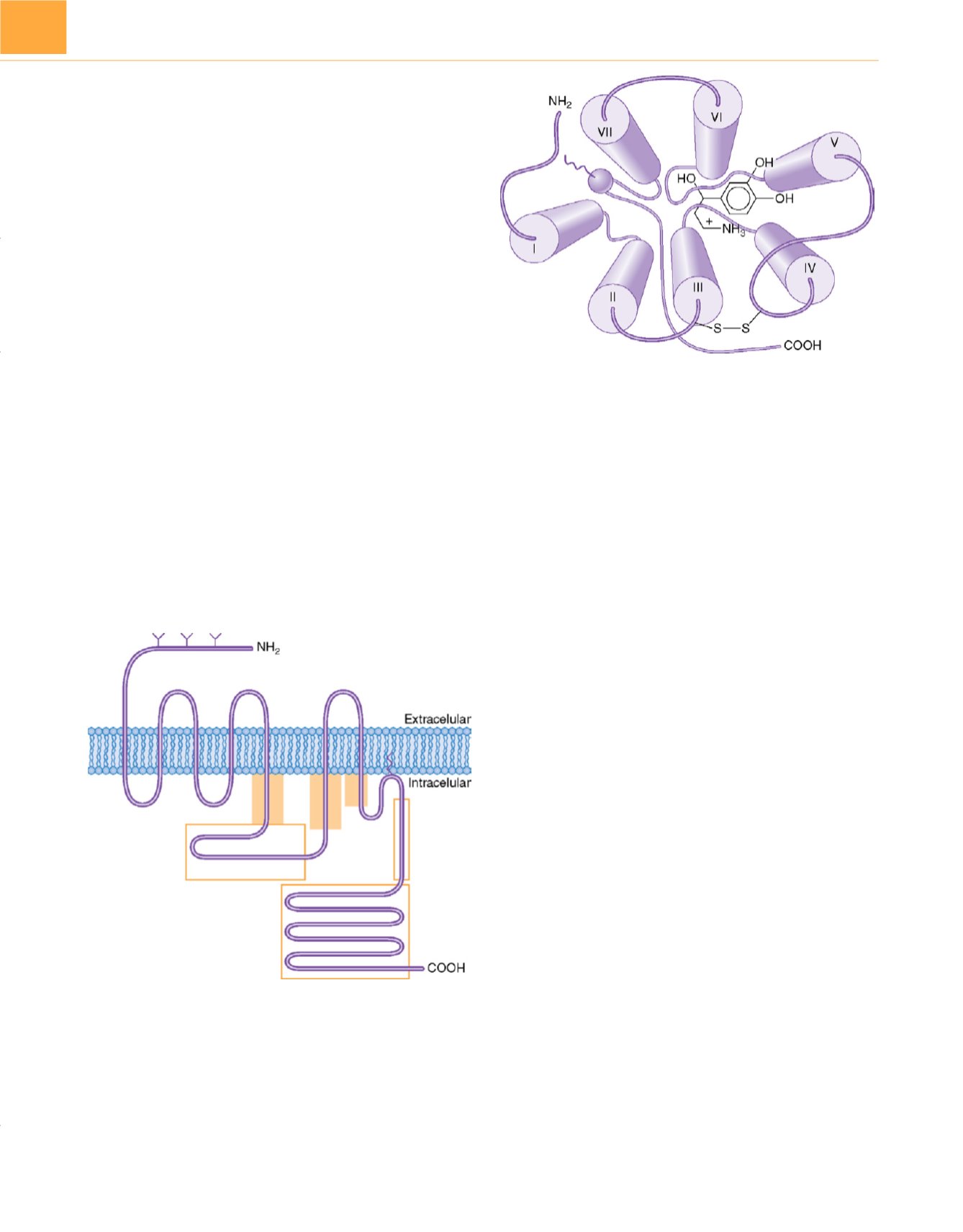
Aunque en la
figura 9-29se muestra un esquema bidimen-
sional, es importante recordar que los receptores acoplados a
proteína G son estructuras tridimensionales con segmentos
transmembrana confluentes alrededor de un sitio central de
unión
( fig. 9-30 ) 14 .Aunque los aminoácidos transmembrana
deben ser en general hidrófobos (para verse favorecidos energé-
ticamente en la membrana lipídica) las cadenas laterales en ami-
noácidos individuales pueden estar cargadas para actuar como
contraiones para anclar al receptor la hormona (hidrosoluble) o
el fármaco cargados.
Canales iónicos
Algunos fármacos anestésicos van dirigidos a canales iónicos regu-
lados por voltaje. Estos receptores intervienen en la señalización
nerviosa regulando la permeabilidad iónica en membranas con
excitabilidad eléctrica, en respuesta a cambios en el potencial de
membrana. Los canales iónicos regulados por voltaje, como el canal
de sodio, tienen regiones cargadas que cruzan la membrana celular.
La formación de pares de iones entre muchas cargas positivas y
negativas ayuda a estabilizar el poro conductor de iones. La regu-
lación por voltaje del canal de sodio es posible gracias a la presencia
de un sensor de voltaje, un grupo de cargas que se mueven bajo la
influencia del campo eléctrico de la membrana celular, de ahí el
nombre de canales iónicos regulados por voltaje. Durante la des-
polarización, los iones sodio con carga positiva se desplazan al
interior celular. El cambio en el potencial de membrana produce
un cambio de conformación en el poro central con reordenación
de pares iónicos que aumentan la permeabilidad al sodio. Los anes-
tésicos locales actúan bloqueando los canales de sodio regulados
por voltaje, como se explica con detalle en el capítulo 20.
La combinación de una proteína receptor clásico con un
canal iónico forma un canal iónico regulado por ligando. Los ca
nales iónicos regulados por ligando permiten a ciertos fármacos
alterar directamente los potenciales de membrana. Numerosos
anestésicos actúan sobre canales iónicos regulados por ligando,
como el receptor nicotínico de la acetilcolina y el receptor GABA
A
.
La
figura 9-31muestra la estructura del receptor GABA
A 15,16. Los
canales iónicos regulados por ligando tienen regiones transmem-
brana hidrófobas y cargadas. Las regiones hidrófobas estabilizan la
estructura de la membrana, mientras que las regiones cargadas
centralmente sirven como poros para el flujo iónico. La unión de
fármacos a canales iónicos regulados por ligando habitualmente
aumenta o disminuye un flujo iónico inducido por neurotransmi-
sor ya existente. Por ejemplo, el neurotransmisor GABA se une a
266
Farmacología y anestesia
II
Figura 9-29
Dibujo esquemático de un receptor acoplado a proteína G. Se
muestra una versión bidimensional de la estructura del receptor con siete
dominios transmembrana, un grupo amino (NH
2
) terminal extracelular (con
sitios de glucosilación asociados [Y]), un grupo carboxilo (COOH) terminal,
residuo cisteína palmitoilado
(línea sinuosa
que se extiende al interior de la
membrana), tres bucles extracelulares y cuatro bucles intracelulares. Están
sombreados
los sitios principales de interacciones de proteína G con el
receptor. Los sitios potenciales de fosforilación en el tercer bucle intracelular
y el grupo carboxilo terminal están en
recuadros
.
Figura 9-30
Dibujo esquemático de la estructura tridimensional del receptor
b
2
-adrenérgico (un receptor acoplado a proteína G prototípico), visto desde el
exterior hacia el interior de la célula. Los dominios transmembrana (
cilindros
numerados con
números romanos
) se unen para formar un sitio de unión. Se
muestra la orientación correcta del agonista noradrenalina. Nótese que la
afinidad del agonista está determinada por aminoácidos específicos
localizados en los dominios transmembrana III, IV y VII. Estos sitios críticos en
los dominios transmembrana se han determinado de modo experimental con
métodos de receptor quimérico y mutagénesis combinados con técnicas
sofisticadas de modelado por ordenador. La confirmación definitiva de estas
estructuras requiere pruebas cristalográficas. Varios laboratorios están
intentando lograrlo. (
Reproducida de Stapelfeldt WH: The autonomic nervous
system:
En
Schwinn DA [ed.]:
Scientific Ptinciples of Anesthesia,
vol. 2.
Filadelfia, Current Medicine, 1998.
)









