
bien caracterizadas de las que disponemos de estructuras de resolu-
ción atómica tridimensionales como luciferasa y albúmin
a 107. Estos
estudios indican que los anestésicos se unen en cavidades con inte-
racciones químicas no covalentes polares y no polares. La unión
implica interacciones mediante enlaces de hidrógeno débiles con resi-
duos aminoácidos polares y moléculas de agua, interacciones de van
der Waals no polares y un efecto polarizante de la cavidad de unión
anfífila en las moléculas anestésicas relativamente hidrófobas. Las
cavidades internas son importantes para la flexibilidad conformacio-
nal involucrada en la regulación del canal iónico y en la transducción
de la señal inducida por ligando de las proteínas del receptor. La
ocupación de un volumen crítico dentro de estas cavidades por los
anestésicos es un mecanismo verosímil de alteración de la función del
receptor y del canal iónico mediante estabilización selectiva de una
conformación particular (p. ej., estado abierto o desactivado de
un canal iónico). Los anestésicos obtienen también energía de unión
de la entropía generada al desplazar el aguaunida desde estos puntos de
unión relativamente promiscuos.Los estudios de los receptores glicina,
GABA
A
y NMDA aportan evidencia convincente de la existencia de
puntos de unión de los anestésicos en proteínas de señalización neu-
ronal crítica
s 108. Se han identificado residuos aminoácidos esenciales
para las acciones de los anestésicos volátiles y, por inferencia, para su
unión en la subunidad
a
del receptor GABA
A 108-110 .Se ha empleado modelado molecular basado en proteínas
estructuralmente homólogas para identificar presuntos puntos de
unión de anestésicos en los dominios transmembrana de los recep-
tores GABA
A
y glicina
( fig. 10-6 ) 111 .Este modelo indica que dife-
rentes fármacos pueden unirse en distintas orientaciones dentro de
una cavidad anfífila individual u ocupar diferentes cavidades en la
proteína con efectos funcionales similares. El perfeccionamiento de
estos modelos moleculares continuará revelando información
sobre el sustrato molecular de la acción de los anestésicos generales
que puede probarse de modo experimental. Los puntos probables
de interacción del xenón y del isoflurano con el receptor NMDA
se han identificado también con este método. Un punto, que puede
alojar hasta tres átomos de xenón o una molécula de isoflurano, se
solapa con el punto de unión conocido de la glicina coagonista en
la subunidad NR1
( fig. 10-7 ) 112 .Esto sugiere que dos anestésicos
inhalatorios químicamente distintos inhiben los receptores NMDA
mediante inhibición competitiva de la unión de agonista.
Anestésicos inhalatorios: mecanismos de acción
289
10
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
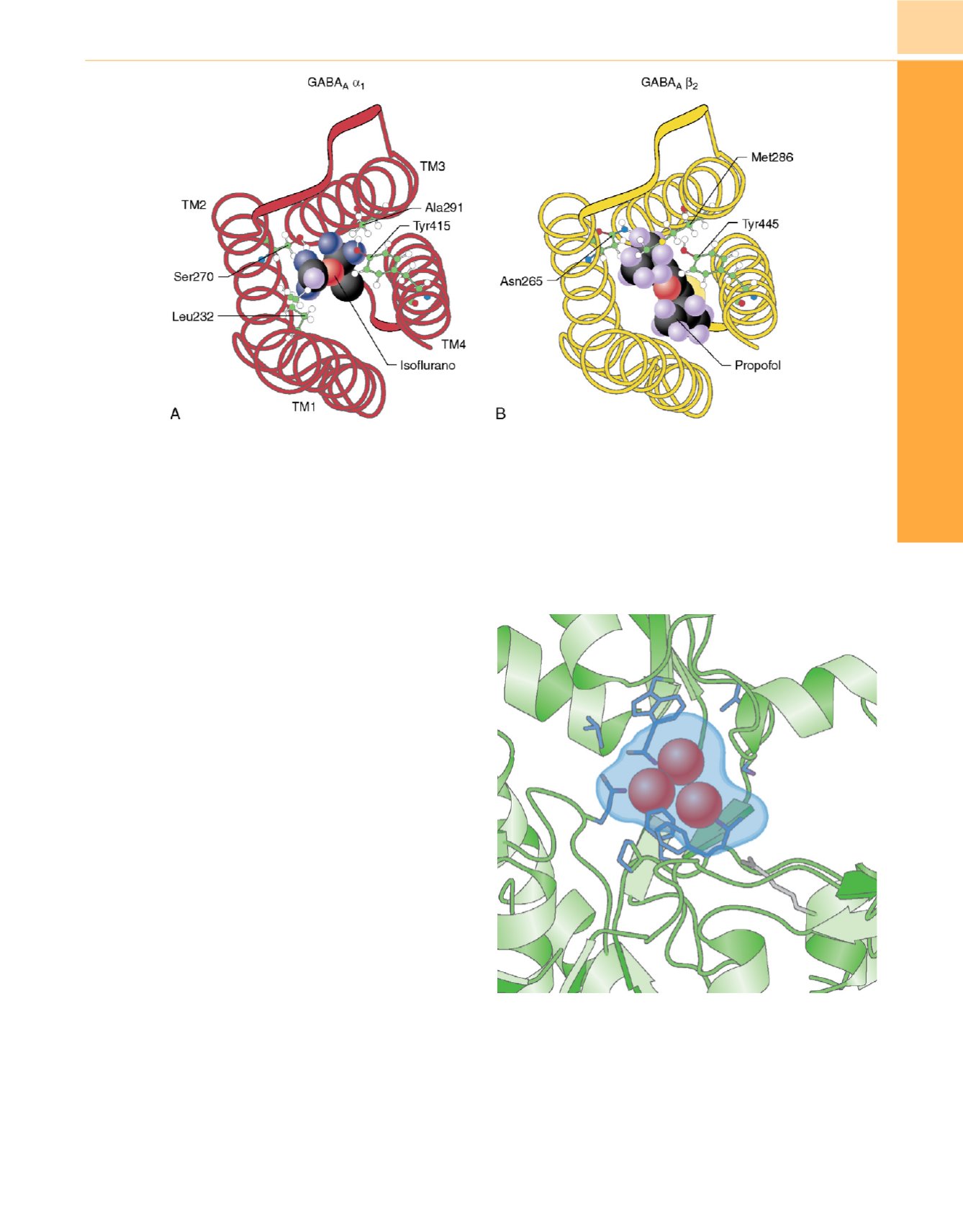
Figura 10-6
Supuestos puntos de unión de los anestésicos en los receptores GABA
A
.
A,
Modelo murino de subunidad
a
1
GABA
A
con Leu232, Ser270, Ala291 y
Tyr415 representados con esfera y bastón. Molécula de isoflurano a la misma escala colocada en el supuesto punto de unión. Las
a
-hélices transmembrana
(TM) están numeradas 1-4.
B,
Modelo correspondiente de subunidad
b
2
GABA
A
con Asn265, Met286 y Tyr445 representados con esfera y bastón. Modelo de
propofol a la misma escala colocado en el supuesto punto de unión.
(De Hemmings HC Jr, Akabas MH, Goldstein PA y cols.: Emerging molecular mechanisms of
general anesthesic action.
Trends Pharmacol Sci
26:503-510, 2005.)
Figura 10-7
Estructura cristalina del dominio de unión a ligando del
receptor
NMDA
con los puntos de unión a xenón previstos en el modelado molecular.
Las
esferas rojas
representan átomos de xenón en el centro de los racimos de
densidad que contienen los puntos de unión. Los puntos de unión a xenón
previstos ocupan el punto ocupado normalmente por glicina. El mismo punto
también es suficientemente grande para acomodar el isoflurano.
(Modificada
de Dickinson R, Peterson BK, Banks P y cols.: Competitive inhibition at the
glycine site of the N-metil
-
d
-
aspartate receptor by the anesthestics xenon and
isofluorane.
Anesthesiology
107:756-767, 2007.)









