
NMDA
( figs. 10-7 y 10-8 ) 70,71,127. Los anestésicos volátiles pueden
inhibir también receptores NMDA aislados a mayores concentra-
cione
s 128 .Junto con la inhibición presináptica de la liberación de
glutamato, esto podría contribuir a la depresión de la transmisión
excitadora mediada por el receptor NMDA.
Una segunda clase de receptores glutamato ionotrópicos son
los receptores no NMDA, que se subdividen en receptores AMP, y
cainato según su sensibilidad a agonistas exógenos selectivo
s 126 .Los
anestésicos inhalatorios inhiben débilmente los receptores AMPA,
por lo que es improbable que ésta sea una acción important
e 129 .Curiosamente los receptores cainato son potenciados por los anes-
tésicos inhalatorios, aunque es improbable que esto intervenga en
la inmovilidad porque la CAM no cambia en ratones deficientes
en la subunidad de receptor GluR
6 130 .La mayor parte de la eviden-
cia sugiere que el mecanismo principal de la depresión de la trans-
misión glutamatérgica por anestésicos volátiles es presináptica, con
contribuciones menores del bloqueo receptor postsináptic
o 117,131-133(v. «Mecanismos celulares»).
Canales iónicos regulados por voltaje
y otros
Canales Na
+
Los canales Na
+
regulados por voltaje son fundamentales para la
conducción axónica, integración sináptica y la excitabilidad neuronal.
A diferencia de los hallazgos en axones gigantes de invertebrado
s 134,
los anestésicos volátile
s 135,136disminuyen la conducción axónica en
axones hipocámpicos amielínicos pequeños (0,1-0,2
m
m) y pequeños
descensos de la amplitud del potencial de acción preterminal reducen
de modo notable la liberación de transmisor y por tanto las respues-
tas postsinápticas en la sinapsis de los mamífero
s 137.
Los canales Na
+
regulados por voltaje de los mamíferos con
expresión heteróloga son sensibles a concentraciones clínicamente
relevantes de anestésicos volátiles. La familia de canales Na
+
con-
siste en nueve subunidades
a
formadoras de poros homólogas con
distintas distribuciones celulares y subcelulare
s 138 .El isoflurano y
otros anestésicos volátiles inhiben las isoformas principales de
los canales Na
+
de los mamíferos, como los canales neuronales
(Na
v
1.2), los del músculo estriado (Na
v
1.4) y los cardíacos (Na
v
1.5),
aunque la isoforma periférica Na
v
1.8 es aparentemente resistent
e 139 .Los anestésicos volátiles, pero no los inmovilizantes, inhiben
también los canales Na
+
nativos neuronales y en terminales nervio-
sa
s 140-143 ,sustentando la noción de que el bloqueo del canal Na
+
contribuye a la depresión de la liberación sináptica de neurotrans-
miso
r 143 .Por el contrario, el xenón no tiene efecto apreciable en los
canales Na
+
, Ca
2+
ni K
+
en miocardiocitos aislado
s 92. La demostra-
ción reciente de que NaChBac, un homólogo procariota de canales
Na
+
regulados por voltaje, también es inhibido por anestésicos
volátiles abre la vía a estudios de función-estructura de estos
canale
s 141 .Canales Ca
2+
Múltiples funciones celulares dependen de una concentración
estrictamente regulada de Ca
2+
libre intracelular ([Ca
2+
]
i
determi-
nada por la acrtividad integrada de los canales Ca
2+
regulados por
voltaje, canales Ca
2+
de capacidad, ATPasas-Ca
2+
(bombas) de
membrana plasmática y retículo sarco/endoplásmico, intercambia-
dores Na
+
/Ca
2+
y secuestro mitocondrial de Ca
2+
. La alteración de
cualquiera de estos mecanismos por los anestésicos podría modi-
ficar muchos procesos celulares regulados por las acciones de
segundo mensajero del Ca
2+
, como transmisión sináptica, expre-
sión de genes, citotoxicidad y acoplamiento excitación-contracción
muscular. Las células excitables convierten su actividad eléctrica
en acción mediante flujos de Ca
2+
mediados principalmente por
canales Ca
2+
regulados por voltaje en la membrana plasmática.
Distintas células y tejidos expresan diferentes subtipos de canales
Ca
2+
que se clasifican funcional y farmacológicamente por el grado
de despolarización necesario para abrir el canal, como los activa-
dos por voltaje bajo (LVA; tipo T) o los activados por voltaje alto
(HVA; tipo L, N, R y P/Q). Más adelante se ha utilizado la identidad
molecular de sus subunidades
a
formadoras de poros para la cla-
sificació
n 144 .Hay evidencia firme de que los anestésicos volátiles
inhiben ciertas isoformas de los canales Ca
2+
pero no otras (para
revisión v. ref.
145 ).
La inhibición de los canales Ca
2+
regulados por voltaje pre-
sinápticos acoplada a liberación de transmisor podría ser el meca-
nismo de reducción de la transmisión excitadora por anestésicos
volátile
s 146. De hecho, los canales tipo N (Ca
v
2.2) y tipo P (Ca
v
2.1),
que intervienen en la entrada de Ca
2+
acoplada a liberación
de neurotransmisor, tienen escasa sensibilidad a anestésicos volá
tile
s 147,148, aunque no en todos los tipos de neurona
s 149, lo que indica
la importancia de las subunidades auxiliares, modificación postra-
ducción u otros probables reguladores de la sensibilidad anestésica.
Anestésicos inhalatorios: mecanismos de acción
291
10
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
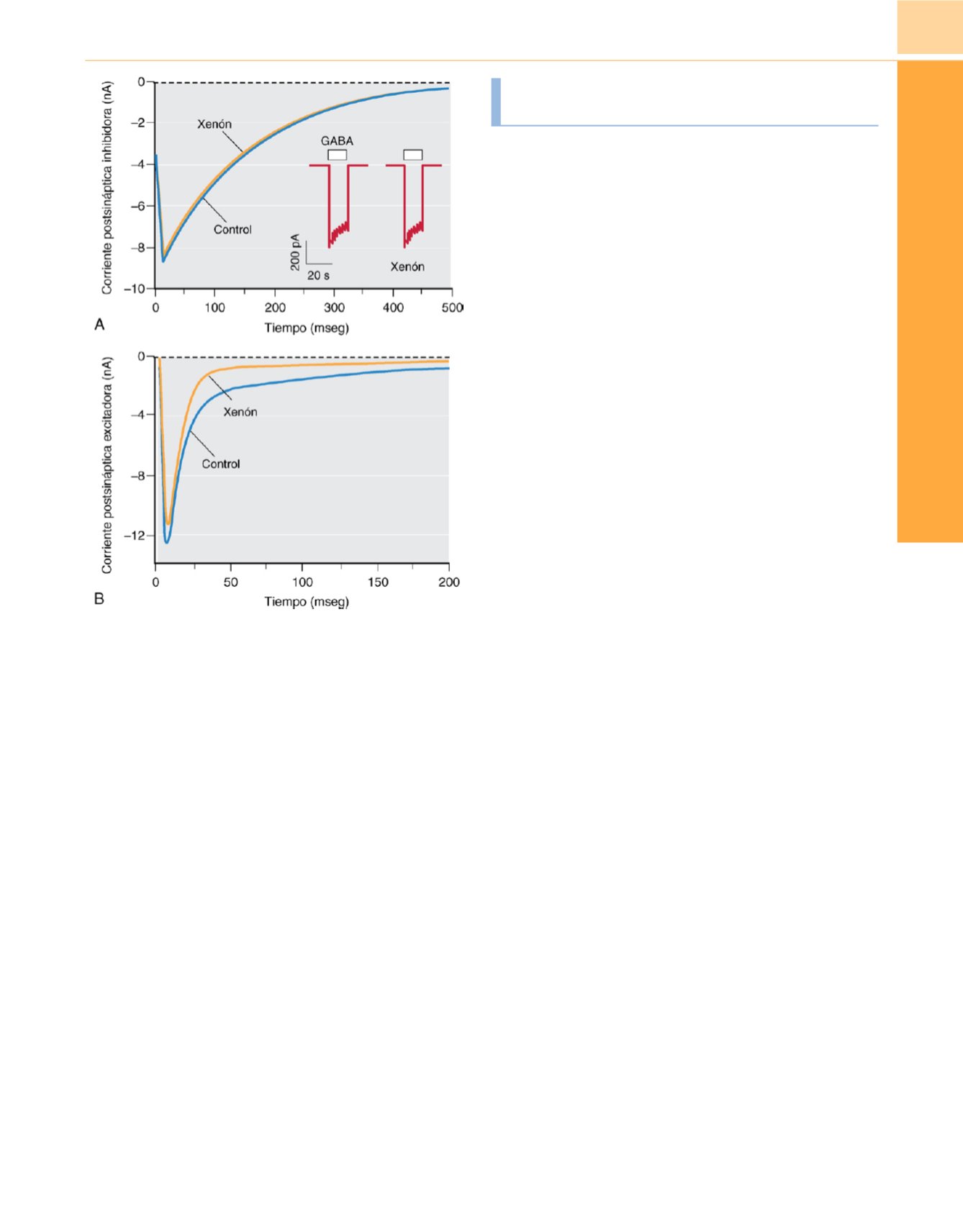
Figura 10-8
Acciones del xenón en las sinpasis glutamatérgicas excitadoras
y gabaérgicas inhibidoras en neuronas de hipocampo de rata en cultivo. El
xenón (3,4mM,
∼
1 CAM) no tiene efecto apreciable en la corriente
postsináptica inhibidora
(A),
pero deprime mucho la corriente sináptica
glutamatérgica excitadora, casi exclusivamente el componente mediado por
el receptor NMDA lento de la corriente
(B).
Por el contrario, los efectos
principales del isoflurano
∼
1 CAM son una prolongación de la desintegración
de la corriente inhibidora y una reducción de la altura máxima de la corriente
excitadora con poco cambio en la evolución temporal (no mostrado;
v.
fig. 10-10).
(Modificado y reproducido con autorización de Sousa SLM
y cols.: Contrasting synaptic activity of the inhalational general anesthetics
isofluorane and xenon.
Anesthesiology
92:1055-1066, 2000.)









