
Sigue sin estar clara la relación temporal entre la apertura de
los canales de K
ATP
mitocondriales y la producción de ROS durante
el precondicionamiento isquémico o farmacológico. Los canales
de K
ATP
mitocondriales desencadenaban el precondicionamiento
mediante la formación de RO
S 139 .La apertura de los canales de K
ATP
mitocondriales producida por agonistas selectivos generaba ROS
que parecían esenciales para la activación de la MAPK y los efectos
favorables subsiguientes frente a la lesión isquémica. Por ejemplo,
el diazóxido, agonista selectivo de los canales de K
ATP
mitocondria-
les aumentaba la viabilidad celular después de hipoxia y reoxige-
nación in vitro, junto con la generación de radicales libres derivados
del oxígen
o 142 .Estas acciones favorables estaban atenuadas en
células tratadas previamente con 5-HD o limpiadores de ROS, lo
que indica que la cardioprotección que producen los agonistas de
los canales de K
ATP
mitocondriales son el resultado de la activación
por ROS. La morfina aumentaba la intensidad de la fluorescencia
de la sonda de 2´,7´-diclorofluoresceína sensible al peroxide de
hidrógeno, acción que bloqueaba la 5-H
D 143 .Estos datos también
demostraban una relación entre la activación de los canales de K
ATP
mitocondriales por opioides y la producción de ROS. El diazóxido
y otros «abridores» de los canales de K
ATP
mitocondriales (cro-
makalima) producían directamente liberación de anión superóxido
del complejo I de la cadena de transporte de electrones en mito-
condrias de corazones de ratas aislados, además de alcalinización
de la matri
z 144 .Por el contrario, otros investigadores indicaban que
los ROS modulaban la actividad de los canales de K
ATP
mitocon-
driales. Por ejemplo, los canales de K
ATP
mitocondriales activados
por anión superóxido derivado de la xantina oxidasa procedente
de miocardio de ventrículo bovino en dos capas de lípido
s 145 .Además, los ROS desencadenaban la apertura de los canales de
K
ATP
mitocondriales, y este hecho generaba posteriormente canti-
dades adicionales de ROS y de N
O 146 .Por tanto, no está claro si la
apertura de los canales de K
ATP
mitocondriales actúa como activa-
dor o como efector terminal en el precondicionamiento isquémico
o farmacológic
o 147 .Sin embargo, parece existir una relación com-
plementaria entre ROS y canales de K
ATP
mitocondriales que puede
crear una retroalimentación positiva entre estos elementos y con-
tribuir así a la cardioprotección.
Tampoco se ha aclarado si la apertura de los canales de K
ATP
mitocondriales por anestésicos inhalatorios precede o sigue a la
producción de ROS durante el precondicionamiento anestésico. La
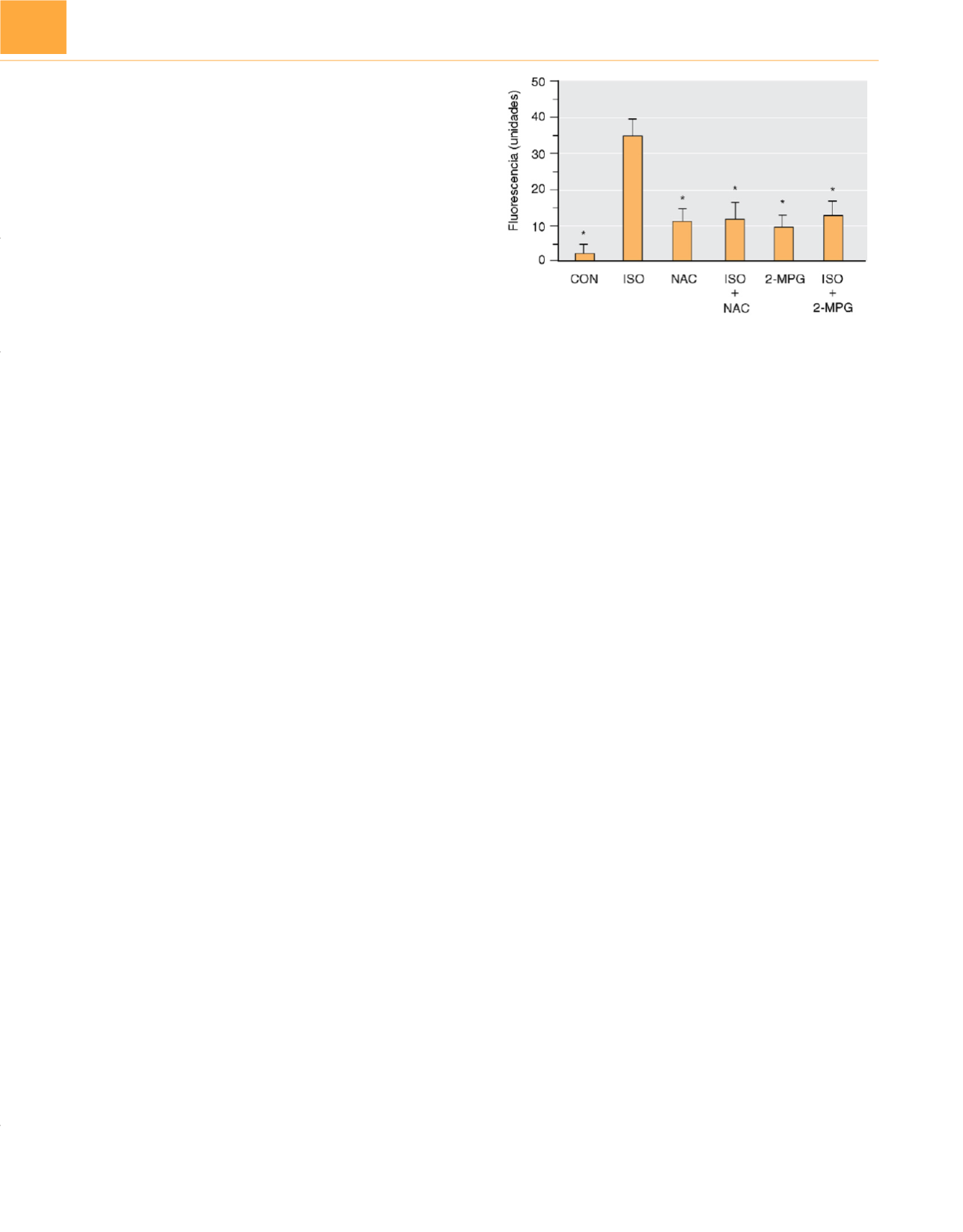
administración previa de 5-HD o un limpiador de ROS (
N
-acetil-
cisteína,
N
-2-mercaptoproprionil glicina) antes de la exposición a
isoflurano,anulaba la producción de ROS en conejo
s 77 .Sin embargo,
la 5-HD administrada antes de la suspensión del isoflurano, pero
antes de una oclusión coronaria prolongada, atenuaba parcial-
mente este efecto, lo que indicaba que la apertura de los canales de
K
ATP
mitocondriales actuaba desencadenando el precondiciona-
miento anestésico mediante la producción de ROS
( fig. 13-13). Por
el contrario, el tratamiento previo con 5-HD no inhibía la produc-
ción de ROS inducida por sevoflurano en corazones aislados de
cobay
a 148 .A pesar del carácter equívoco de estos dos estudio
s 77,148,
es bastante evidente que los ROS tienen una función esencial en el
precondicionamiento anestésico junto con los canales de K
ATP
mitocondriales. La cantidad de ROS que supera un umbral crítico
producía apertura de las mPTP y una nueva liberación de RO
S 149que estimulaba la posterior producción de ROS en otras mitocon-
dria
s 150 .Esta «liberación de ROS inducida por ROS» contribuía a
la muerte celular dependiente de mPTP en miocitos de ratas
adultas después de la isquemia-reperfusió
n 151 .Por tanto, los anes-
tésicos inhalatorios u otros activadores de la apertura de los canales
de K
ATP
mitocondriales, pueden impedir la apertura de los mPTP
por mecanismo sensible a la oxidación para producir cardiopro-
tección. El precondicionamiento por desflurano aumentaba la
resistencia de la apertura de mPTP inducida por Ca
2+
130 ,pero no
se ha estudiado la dependencia de este proceso de los ROS. Se
necesitan más estudios para definir con claridad la relación precisa
entre ROS, canales de K
ATP
mitocondriales y mPTP durante el
precondicionamiento anestésico.
El NF-
k
B es un factor de trascripción importante activado
durante la lesión por isquemia-reperfusión, que está implicado en
la respuesta inflamatoria al estrés oxidativo. La proteína reguladora
I
k
B-
a
mantiene al NF-
k
B en su forma inactiva en condiciones
normales, pero la activación de I
k
B-
a
cinasa por ROS u otras
citocinas inflamatorias durante la isquemia anulan esta inhibición
pasiva NF-
k
B. El NF-
k
B disociado se transloca al núcleo, se une a
regiones promotoras de genes e inicia la trascripción. El precondi-
cionamiento isquémico disminuye la activación de NF-
k
B y dismi-
nuye la producción de citosinas inflamatorias, quimocinas y
moléculas de adhesión, contribuyendo de esta forma a la disminu-
ción de la necrosis miocárdica. El precondicionamiento con sevo-
flurano también atenuaba la activación de NF-
k
B y disminuía la
expresión de genes inflamatorios dependientes de NF-
k
B en cora-
zones aislados de rata
s 61 .Estos datos indican que la inhibición de
NF-
k
B también media el precondicionamiento anestésico. El papel
de los ROS en este proceso todavía no se conoce.
Se ha demostrado que los ROS derivados de la fosforilación
oxidativa mitocondrial median el precondicionamiento isqué-
mic
o 152y farmacológic
o 143 .El inhibidor del complejo III mioxitia-
zol inhibía la producción de ROS inducida por hipoxi
a 152y
acetilcolin
a 153y anulaba el precondicionamiento in vitro. Los anes-
tésicos inhalatorios inhibían los complejos I y II de transporte de
electrones en mitocondrias cardíacas aislada
s 154,155. La inhibición
del complejo I inducida por sevoflurano estaba atenuada por un
activador de la superóxido dismutas
a 155y un inhibidor de NO
S 156 ,lo que indica que los ROS, el NO, o sus productos de reacción,
pueden inhibir la respiración mitocondrial por un mecanismo de
retroalimentación positiva para amplificar señales de radicales
libres y desencadenar el precondicionamiento anestésico. Por el
contrario, dado que el mixotiazol, pero no un inhibidor del com-
plejo I, anulaban la cardioprotección por isoflurano y la formación
de RO
S 157, se pensaba que el complejo III puede ser el origen de
ROS durante el precondicionamiento anestésico. Estos datos indi-
caban la posibilidad de que los anestésicos inhalatorios modulen
múltiples sitios de la cadena de transporte de electrones directa o
indirectamente por un mecanismo de retroalimentación mediado
por ROS. El celecoxib, inhibidor de la ciclooxigenasa-2 (COX-2),
380
Farmacología y anestesia
II
Figura 13-13
Producción de anión superóxido medida con fluorescencia por
dihidroetidio en conejos control (CON) y conejos tratados con
N
-acetilcisteína
(NAC) o
N
-2-mercaptopropionil glicina (2-MPG) en presencia y ausencia de
isoflurano a 1,0 CAM (ISO). *Diferencia significativa (
P
<
0,05) del isoflurano.
(De Tanaka K, Weihrauch D, Kehl F y cols.: Mechanism of preconditioning by
isoflurano in rabbits: a direct role for reactive oxygen species.
Anesthesiology
97:1485-1490, 2002.)









