
Todavía no se conoce con exactitud el mecanismo por el que
los anestésicos inhalatorios producen cardioprotección durante la
reperfusión. El halotano anulaba la atenuación de las oscilaciones
de la concentración del Ca
2+
mioplásmico dependiente del RS
inducida por reoxigenación en miocitos cardíaco
s 196 .Esto
s 196y
otros hallazgo
s 200indicaban que los anestésicos inhalatorios pueden
impedir la sobrecarga de Ca
2+
intracelular durante la reperfusión
precoz. El isoflurano y el sevoflurano también disminuían la adhe-
sión postisquémica de leucocitos polimorfonucleare
s 201 .Sin em
bargo, en estos estudios previos no se ha aclarado cómo actúan
los anestésicos inhalatorios para disminuir la sobrecarga de Ca
2+
intracelular o atenuar las consecuencias negativas de los interme-
diarios de radicales de oxígeno durante la reperfusión precoz.
Aunque es tentador proponer que vías de señales similares median
el precondicionamiento y el poscondicionamiento anestésicos, se
han observado diferencias considerables entre las respuestas genó-
micas asociadas a estos fenómeno
s 202 .Estos hallazgos indican que
sus mecanismos responsables pueden no ser idénticos.
Chiari y cols. demostraron que la exposición breve a
1 CAM de isoflurano administrado durante los 3 minutos finales
de la oclusión de la arteria coronaria y los 2 primeros de la reper-
fusión, disminuyen el tamaño del infarto en conejo
s 203. El grado
de preservación miocárdica observada en el poscondiciona-
miento con isoflurano fue parecido a la cardioprotección alcan-
zada en el precondicionamiento con isoflurano enuna preparación
experimental idéntic
a 77. El poscondicionamiento con isoflurano
a 0,5 CAM (concentración que aislada no produce cardioprotec-
ción) también disminuyó el umbral de tiempo necesario para el
poscondicionamiento isquémico. La administración previa del
antagonista selectivo de PI3K wortmanina bloqueó los efectos
favorables del isoflurano antes y después de la reperfusión precoz
con o sin poscondicionamiento isquémico subumbral. El isoflu-
rano también aumentó la fosforilación de la proteína diana Akt
de la vía de PI3K, y este efecto también fue inhibido por la admi-
nistración previa de wortmanina. Estos datos demostraban por
primera vez que la activación de la vía de señal PI3K media
Farmacología cardiovascular
383
13
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
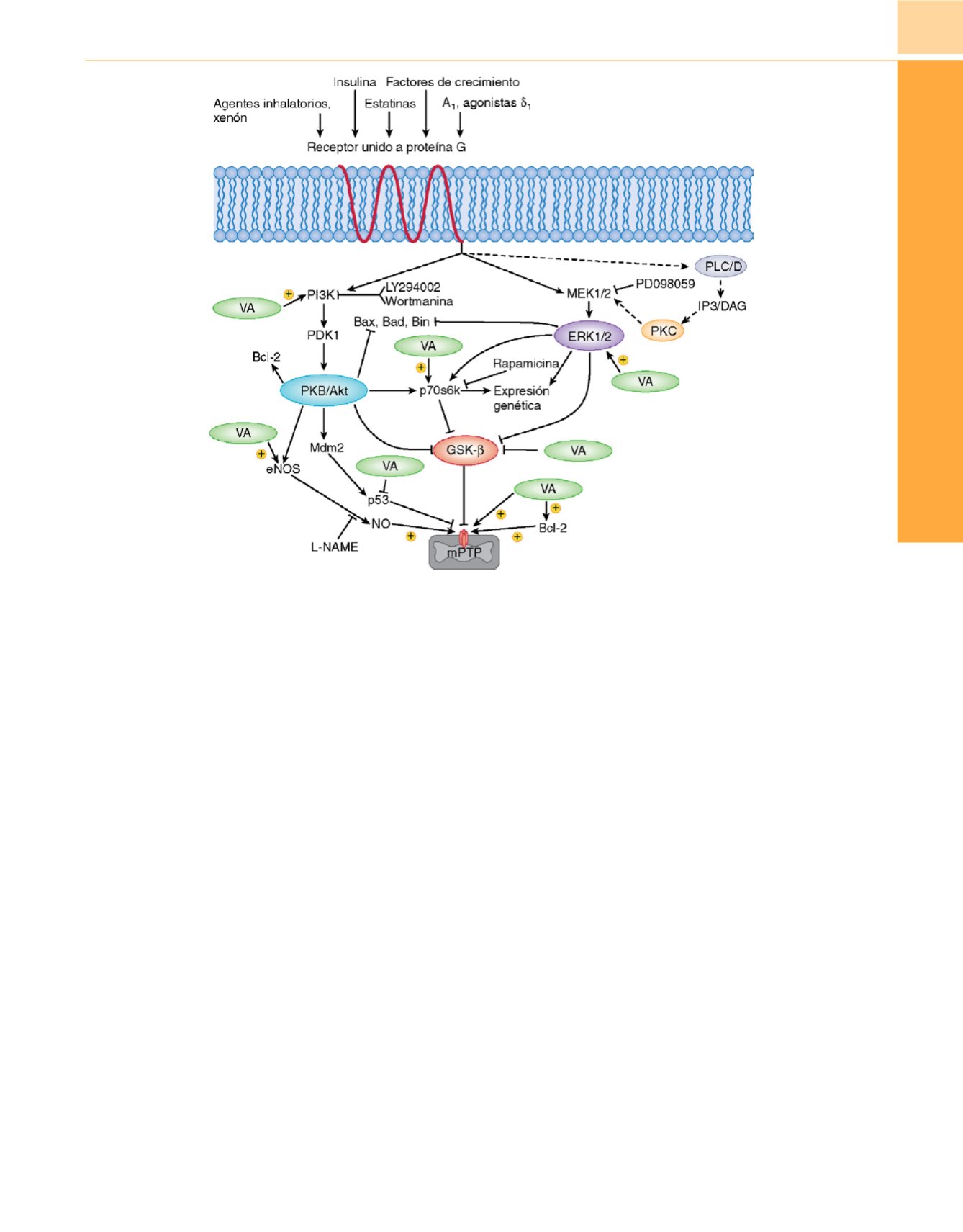
Figura 13-14
Ilustración esquemática que representa los posibles sitios de acción de los anestésicos inhalatorios (AI) en la vía de señales de cardioprotección
durante la reperfusión precoz. Los ligandos de receptores unidos a la proteína G (adenosina A
1
, opioide
d
1
), AI, insulina, estatinas y factores de crecimiento
activan las cascadas paralelas de la fosfoinositol 3-cinasa (PI3K) y la cinasa regulada por señal extracelular (ERK1/2) para producir protección. La activación de
proteína G acoplada de proteincinasa C (PKC) por fosfolipasas (PLC/D) a través del segundo mensajero diacilglicerol (DAG) e inositol trifosfato (IP3) también
contribuye a la activación de las PI3K y ERK1/2. La PI3K fosforila la cinasa dependiente de fosfoinositida (PDK1), que activa Akt (también llamada proteincinasa B
[PKB]). Este radical estimula la actividad de las proteínas antiapoptósicas (B-células de linfoma B-2 [Bcl-2]) e inhibe simultáneamente la actividad de las proteínas
proapoptósicas (Bax, Bad, Bim, caspasas). Akt/PKB también inhibe la isoforma
b
de glucógeno sintasa cinasa (GSK-
b
) y activa la sintasa de óxido nítrico
endotelial (eNOS), la cinasa s6 de la proteína ribosómica de 70kd (p70s6K) y la proteína murina (Mdm2). La p70s6K también inhibe la actividad de GSK-
b
. El
óxido nítrico (NO) producido por los eNOS inhibe mientras que la fosforilación de la proteína proapoptosis p53 inducida por Mdm2 abre los poros de transición
de permeabilidad mitoconfrial (mPTP). La inhibición de GSK-
b
y la activación de los canales de K
ATP
mitocondriales también actúan cerrando los mPTP. El estado
de transición del poro mitocondrial es crítico para preservar la integridad mitocondrial y la viabilidad celular durante la isquemia y reperfusión. La activación
de ERK1/2 también inhibe a la GSK-
b
y bloquea la formación de proteínas de proapoptosis. LY294002 y wortmanina, rapamicina, PD 098059 y el metiléster de
l
-arginina (L-NAME) bloquean la actividad de PI3K, p70s6K, ERK1/2 y eNOS, respectivamente. Se ha propuesto que los anestésicos inhalatorios refuerzan la
actividad de PI3K-Akt, p70s6k, ERK1/2 y eNOS. También se ha sugerido que inhiben directamente a la GSK-
b
y los mPTP junto al refuerzo de la expresión
de Bcl-2 y la inhibición de p53. La activación de los canales de K
ATP
mitocondriales inducida por anestésicos inhalatorios también inhibe los mPTP. Estas
acciones de los anestésicos inhalatorios pueden contribuir a los efectos cardioprotectores durante la reperfusión precoz.









