
de los anestésicos. La inducción enzimática puede ser ahora más
frecuente en pacientes sometidos a intervenciones quirúrgicas
teniendo en cuenta la frecuencia de polimedicación.
La inhibición enzimática puede tener un efecto en la activi-
dad terapéutica y en la toxicidad tan importante como la induc-
ción. Puede producir un aumento de la concentración plasmática
del fármaco original y una disminución de sus metabolitos, así
como efectos farmacológicos exagerados y prolongados y un
aumento del potencial tóxico. Muchos compuestos inhiben la acti-
vidad de las enzimas que metabolizan los fármacos y por tanto
alteran la duración e intensidad de la acción farmacológica y la
gravedad de los efectos tóxicos. Existen varios mecanismos de
inhibición. Los inhibidores de la síntesis proteica como la ciclohexi-
mida disminuyen la síntesis enzimática y así reducen la concen-
tración de enzimas. Otros fármacos son inhibidores reversibles
que compiten por el sitio activo de la misma enzima responsable
del metabolismo del medicamento en cuestión. Otro grupo son
inhibidores irreversibles que degradan el hemo del citocromo
P450. La inhibición de CYP3A es frecuente y significativa debido
a la alta expresión de CYP3A en el epitelio intestinal y al hecho de
que la ingestión oral sea la vía de entrada más frecuente de los
fármacos. Después de la ingestión oral, la biodisponibilidad
aumenta por una disminución del metabolismo de primer paso.
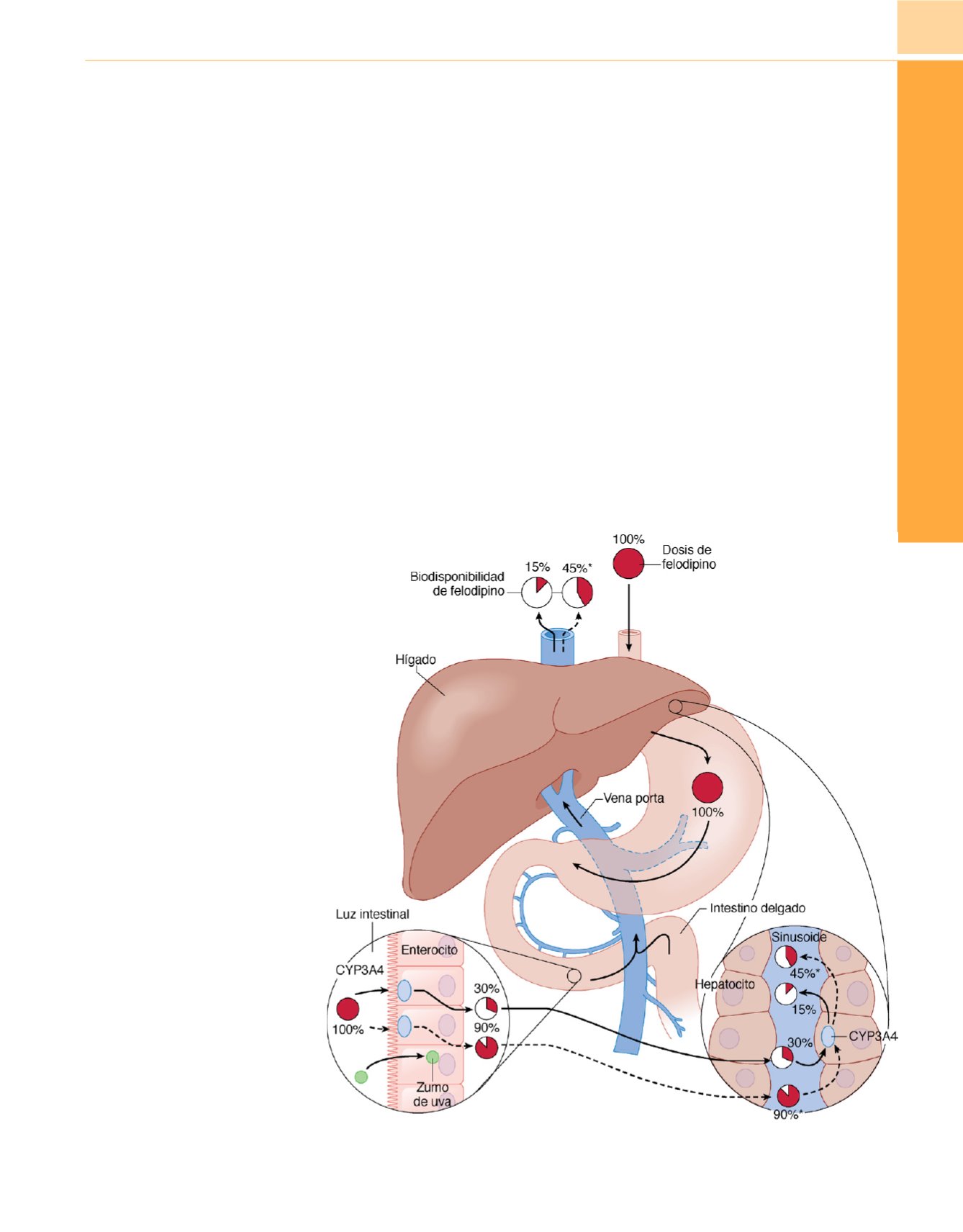
Cuando se toma zumo de uva se observa inhibición de CYP3A4.
El consumo regular de 250ml de zumo de uva inhibe la actividad
intestinal de CYP3A4. Los pacientes que toman felodipino oral
con este zumo, sufren efectos secundarios debido a una sobredosis
de este antagonista de los canales del calcio, como hipotensión y
taquicardia, debido a la disminución de la concentración de
CYP3A4
( fig. 14-4 ) 8 .Entre los inhibidores potentes de CYP3A
están el ritonavir, el diltiazem, la nicardipina, el verapamil y varios
fármacos anti-VIH (delavirdina, indinavir, ritonavir y saquinavir).
Otros inhibidores más generales de CYP son la amiodarona, la
cimetidina y los antibióticos macrólidos eritromicina, claritromi-
cina y troleandomicina.
Se han observado diferencias ligadas al sexo en el metabo-
lismo, especialmente con el CYP3A, pero son poco relevantes com-
paradas con las ya descritas. El tratamiento de las convulsiones
durante el embarazo con difenilhidantoína constituye una excep-
ción. Al ser el hígado el órgano principal de metabolismo de los
fármacos, una hepatopatía intrínseca que produce disfunción del
hígado puede alterar este mecanismo. Enfermedades como la
hepatitis, la cirrosis biliar primaria, la hepatopatía etílica, la cirrosis
y el hepatocarcinoma pueden disminuir la actividad enzimática
hasta un 50%. Puede haber también insuficiencia cardíaca grave
con disminución de la perfusión hepática y deterioro del metabo-
lismo, como indica la necesidad de dosis dobles de carga y de
mantenimiento de lidocaína para el tratamiento de las arritmias en
pacientes con insuficiencia cardíaca. Además, algunas infecciones
víricas pueden inhibir las reacciones mediadas por CYP.
Anestésicos inhalatorios: metabolismo y toxicidad
403
14
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
Figura 14-4
Metabolismo de primer
paso después de la administración oral
de un fármaco, tomando como ejemplo
el felodipino y su interacción con el
zumo de uva. Las enzimas CYP3A (p. ej.,
CYP3A4) presentes en enterocitos del
epitelio intestinal metabolizan el
felodipino ampliamente durante su
absorción, y sólo un 30% de la dosis
administrada llega a la vena
(línea
continua)
. A continuación, las enzimas
CYP3A del hígado metabolizan el
fármaco de manera que sólo queda
biodisponible el 15% de la dosis, que
llega a la circulación sistémica donde
puede ejercer su efecto. El zumo de uva
inhibe selectivamente las CYP3A en el
enterocito, produciendo por tanto un
aumento de la disponibilidad de
felodipino de 3 veces, marcado por los
asteriscos y las líneas discontinuas.
(De Wilkinson GR: Drug metabolism and
variability among patients in drug
response.
N Engl J Med
352:2211-2221,
2005.)









