
Metabolismo estereoselectivo de los anestésicos
inhalatorios
Hasta hace poco tiempo, la estereoquímica de los fármacos ha sido
un área relativamente descuidada en lo que se refiere a la prepara-
ción de medicamentos. Muchos fármacos, como los anestésicos
fluorados, se preparan y utilizan en medicina como mezclas racé-
micas. Una mezcla racémica contiene dos enantiómeros en iguales
cantidades. Los enantiómeros son imágenes en espejo simples que
no se pueden superponer, como las manos derecha e izquierda. La
experiencia clínica ha confirmado que las formas enantioméricas
de los fármacos pueden tener diferente potencia, toxicidad y accio-
nes y propiedades farmacológicas y farmacocinética
s 64-67. Estos
objetos que no se pueden superponer se llaman quirales. El origen
más frecuente de los quirales es la presencia de un centro asimé-
trico, un átomo de carbono unido a cuatro grupos de sustitución
diferentes. Los enantiómeros son activos ópticamente; una forma
enantiómera simple rota el plano de luz polarizada que pasa a
través de una solución acuosa del enantiómero en el sentido de las
agujas del reloj o al contrario. El método preferido por el Interna-
tional Union of Pure and Applied Chemistry (IUPAC) para la
clasificación de los enantiómeros es la convención de Cahn-Perlog-
Ingold o clasificación
(R
/
S)
. En este sistema, se asigna distintas
prioridades a las cuatro sustituciones en torno al centro quiral,
en función de su número y masa atómicos. Cuando los grupos de
sustitución están ordenados de superior a inferior en el sentido
de las agujas del reloj a partir de la sustitución de menos prioridad
unida al carbono, se asigna al conjunto la configuración
(R),
si el
orden es en dirección contraria se designa la configuración
(S)
.
La disminución del coste de producción de las soluciones
enantioméricas purificadas ha permitido que aumente su utiliza-
ción clínica. Las ventajas de un estereoisómero simple dependen
de las propiedades farmacocinéticas y farmacodinámicas de los
respectivos enantiómeros. Por ejemplo, la penicilamina
(S)
se
utiliza para tratar la enfermedad deWilson, la cistinuria y la artritis
reumatoide dada la toxicidad de la forma racémic
a 68 .El bloqueante
de los canales del calcio verapamilo
(S)
es de 10 a 20 veces más
potente que el verapamilo
(R)
y por tanto parece ser mejor antia-
rrítmico, antianginoso y antihipertensiv
o 69. El fármaco cardiovas-
cular propranolol
(S)
es útil en medicina como antihipertensivo y
antianginoso, mientras que el propranolol
(R),
que no tiene efectos
cardiovasculares, es útil en el tratamiento del hipertiroidism
o 70,71.
La ketamina se prepara para su uso clínico como mezcla racémica,
aunque la ketamina
(S)
tiene una eficacia superior, se elimina con
mayor rapidez, tiene mejores características de recuperación y
menos efectos secundarios (que varían desde inquietud a agitación
y urgencias médicas) que la ketamina racémic
a 72. La ketamina
(S)
también es tres veces más potente que la ketamina
(R)
como anes-
tésico y analgésico, y se ha demostrado una estereoselectividad
enantiomérica del metabolismo hepático de la ketamina por los
microsomas hepático
s 73 .La ropivacaína, el enantiómero
(S)
de un
homólogo de bupivacaína, y la levobupivacaína (bupivacaína
[S]
)
se desarrollaron como alternativas a la bupivacaína racémica por
su conocida toxicidad cardiovascular y neurológica. La ropivacaína
es menos potente que la bupivacaína
(S)
o la bupivacaína racémica
como bloqueante de los canales de sodio, aunque los efectos anes-
tésicos y analgésicos de los dos fármacos son similare
s 74. Aunque
la bupivacaína y la ropivacaína demuestran una unión similar a las
proteínas del plasma la ropivacaína tiene menor solubilidad lipí-
dica, mayor aclaramiento plasmático y una vida media de elimina-
ción (t
1/2
b
) más corta que la bupivacaína racémic
a 75. También la
levobupivacaína ha demostrado menor toxicidad en comparación
con su isómero
(R
) 76. El cisatracurio
(R)
ofrece ventajas sobre el
atracurio racémico por su carencia de propiedades liberadoras de
histamina y su mayor potencia para el bloqueo neuromuscular. El
etanol se utiliza mucho como disolvente farmacéutico y se ha
demostrado hace poco tiempo que disminuye la fracción libre de
warfarina
(S),
mientras que aumenta la fracción libre de warfarina
(R)
. Puede que el ejemplo más tristemente célebre de las diferencias
enantiomérica entre isómeros ópticos se haya observado con el
fármaco talidomida. Los isómeros
(R)
y
(S)
de talidomida, así
como su mezcla racémcia tienen la misma actividad hipnótica; sin
embargo, la talidomida
(S)
se transforma en metabolitos que pro-
vocaron efectos embriogénicos y teratogénico
s 77 .El halotano comercial es una mezcla racémica de los enan-
tiómeros
(R)
y
(S)
( fig. 14-10). Como ya se ha comentado, en
estudios metabólicos se ha demostrado que el halotano racémico
sufre metabolismo oxidativo catalizado por CYP2E1 a TFA-Cl, que
se une de forma covalente a varias proteínas hepáticas que se cree
que están implicadas en la respuesta inmune que produce hepato-
toxicidad por halotano. Para estudiar si la CYP2E1 cataliza el
metabolismo del halotano de forma estereoselectiva, se prepararon
los enantiómeros de halotano y se analizó in vivo su capacidad
para formar enlaces covalentes TFA-cuerpos de inclusión protei-
cos en hígado de ratón. Se observó que el halotano sufre meta-
bolismo estereoselectivo, y que el isómero
(R)
produce mayor can
tidad de TFA-complejos de inclusión en el hígado que el isó
mero
(S)
( fig. 14-11 ) 78. Puesto que la potencia anestésica de los
isómeros parece ser igua
l 79 ,estos hallazgos indican que el isómero
(S)
de halotano puede ser un anestésico inhalatorio más seguro
que el isómero
(R)
o la mezcla racémica. Esta idea se apoya en la
observación de que la hepatotoxicidad por halotano, enflurano,
isoflurano y desflurano se relaciona con su grado relativo de meta
bolismo oxidativo in vivo a metabolitos acil hálidos (v.
fig. 14-8).
Anestésicos inhalatorios: metabolismo y toxicidad
409
14
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
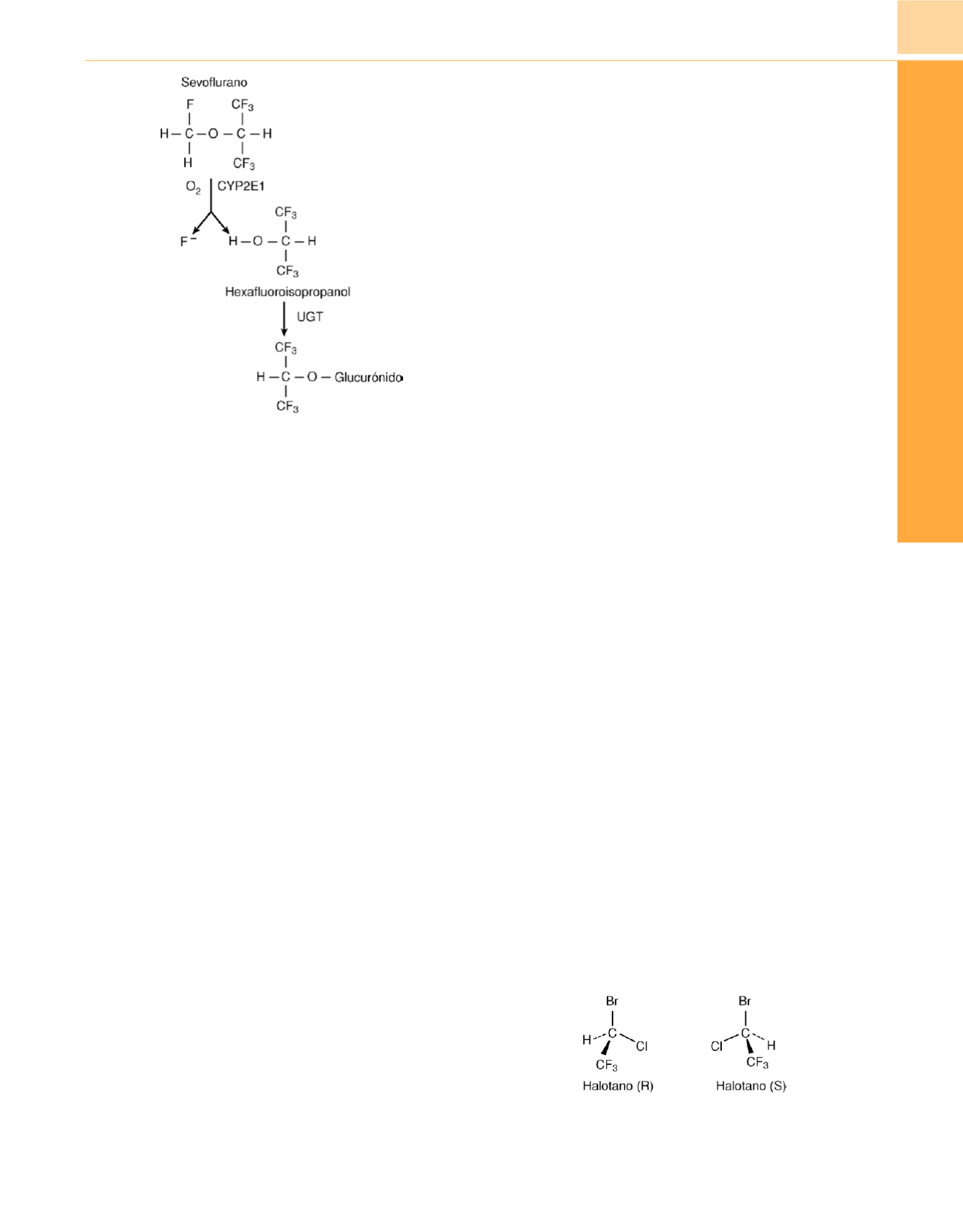
Figura 14-9
Metabolismo in vivo del sevoflurano a flúor inorgánico
y hexafluoroisopropanol. UGT, uridina 5
′
-difosfato glucuronosiltransferasa.
Figura 14-10
Enantiómeros
(R)
y
(S)
del halotano.









