
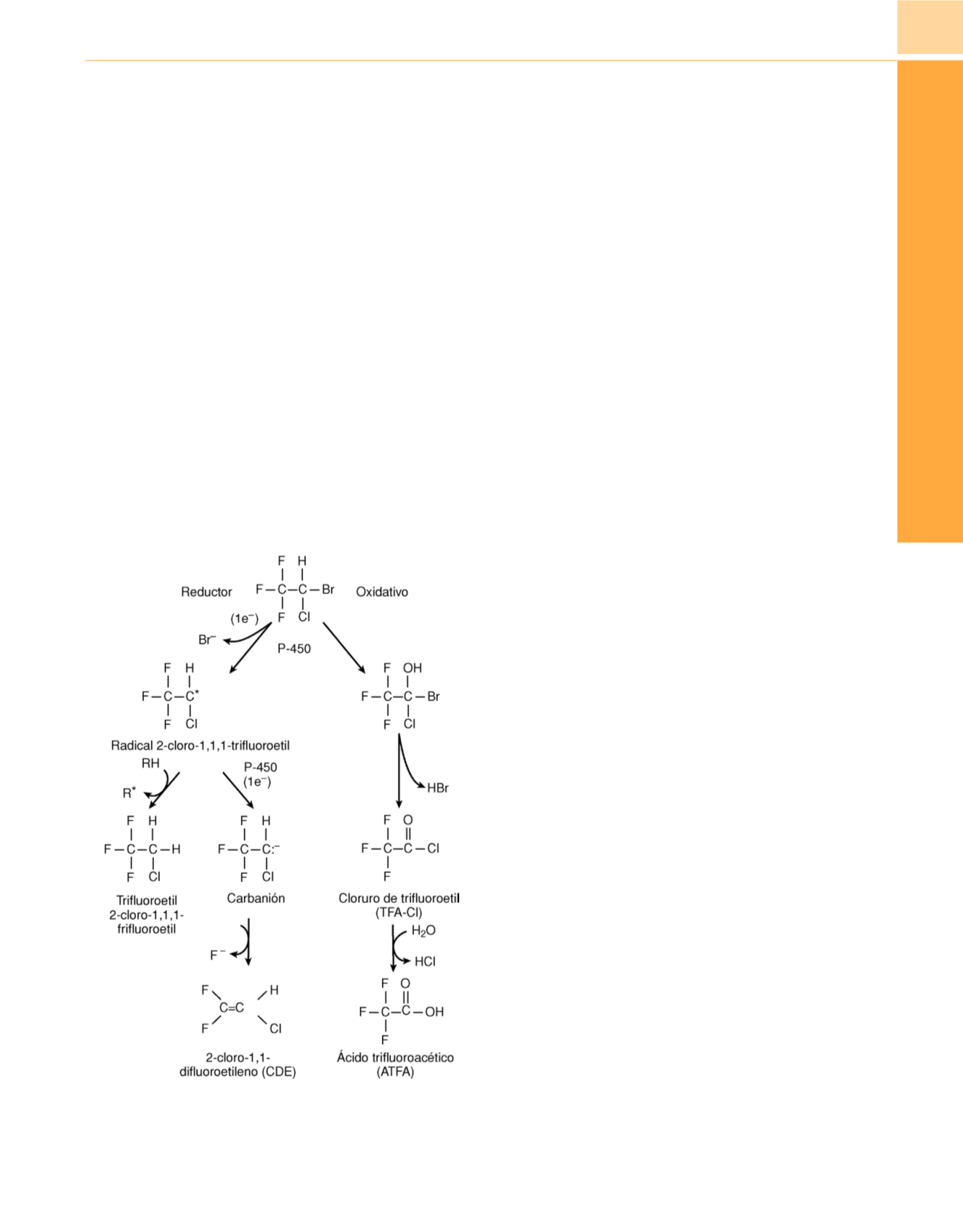
 (
fig. 14-7
(
fig. 14-7
). El principal metabolito en seres humanos es el ácido
trifluoroacético (CF
3
COOH), que deriva del metabolismo oxi-
dativo sobre todo por CYP2E1 y en menor medida por
CYP2A
6 46. El paso que limita la velocidad del metabolismo oxi-
dativo es la rotura de la unión carbono-hidrógeno. El primer
metabolito intermedio que se forma, es probablemente el 1,1,1-
trifluoro-2-cloro-2-bromoetanol, que debería descomponerse
rápidamente para producir bromuro de hidrógeno y el metabo-
lito reactivo trifluoroacetil cloruro (TFA-Cl). Este último reac-
ciona con el agua para producir ClH y ácido trifluoroacético, y
con fosfatidiletanolamina, un fosfolípido de las membranas,
para formar
N
-trifluoroacetil-2-aminoetanol, que se ha iden
tificado en orina. El metabolito del halotano TFA-Cl también
reacciona con las proteínas tisulares y forma complejos de
inclusión proteín-trifluoroacetilados, que se comentará en la
sección de hepatotoxicidad. Aunque se ha identificado trifluo-
roetanol en la orina de animales de experimentación, este meta-
bolito y su conjugado glucorónico no se han encontrado en la
orina humana. El trifluoroacetaldehído, otro posible metabolito,
tampoco se ha aislado en la orina humana.
Una ruta alternativa y menos importante del metabo-
lismo del halotano (
<
1% del halotano absorbido) tiene lugar
a través de la vía reductora que necesita tensiones bajas
de oxígeno y puede ser catalizada por CYP2A6 y CYP3A4
(v.
fig. 14-7 ) 46. El Br
−
y el F
−
inorgánicos son productos
terminales de esta vía. En los gases exhalados por pacientes
anestesiados con halotano se identificaron dos metabolitos
volátiles (2-cloro-1,1-difluoro-etileno [CDE] y 2-cloro-1,1,1-
trifluoretano [CTE]) y un producto volátil de descomposición
del (2-bromo-2-cloro-1,1-difluoroetileno [DBE]). La formación
de CDE y la liberación de F
−
probablemente sean el resultado
de la cesión de dos electrones del halotano mediada por CYP,
mientras que la formación de CTE y la producción de radicales
libres titulares se deben a la cesión de un electrón mediada por
CYP. La inactivación suicida de los CYP que se observa en
condiciones de hipoxia (
<
40 mmHg O
2
) puede ser consecuen-
cia de la unión covalente de un reactivo intermediario de CTE
a CYP formado durante el metabolismo de CTE por CYP. Una
vía principal de formación de DBE es la deshidrofluoración del
halotano como resultado de su interacción con sosa cálcica. El
CYP2E1 es inducido por etanol e isoniazida e inhibido por
disulfira
m 47. La exposición prolongada a concentraciones suba-
nestésicas de halotano produce un aumento del metabolismo
de los fármacos en seres humanos.
Enflurano
El enflurano (CHF
2
-O-CF
2
-CHClF) ya no se utiliza en Estados
Unidos, pero el estudio de su metabolismo demuestra cómo
cambios relativamente menores en su estructura química pueden
afectar intensamente a todo el metabolismo. Cerca del 2,5% del
enflurano absorbido se metaboliza
( fig. 14-8). La oxidación
inicial y la rotura de la unión carbono-hidrógeno puede darse
en el carbono clorofluorometil o en el difluorometil. Los estu
dios del metabolismo del enflurano en microsomas hepáticos
humano
s 48y el aislamiento de ácido difluorometoxidifluoroacé-
tico de hígado de rata, orina humana, microsomas hepáticos
humanos y ADNc que expresa CYP2E1
48indican que el metabo-
lismo primario se produce en el carbono clorofluorometil. La
detección de cantidades inapreciables de ácido clorofluoroacé-
tico sugiere que el metabolismo en el carbono difluorometil es
escaso. El intermediario reactivo que se forma por la oxidación
en el carbono clorofluorometil puede hidrolizarse para producir
ácido difluorometoxidifluoroacético o proteínas tisulares acetila-
das que producen cuerpos de inclusión con potencial inmuno-
genético
49 .En ambos casos, el producto de estas reacciones
químicas es el F
−
inorgánico.
Los pacientes quirúrgicos tratados con fenobarbital, difeni-
lhidantoína o diazepán de forma crónica, o que consumieron
etanol antes de la anestesia con enflurano, no tenían concentracio-
nes séricas altas de F
−
en comparación con los no tratados. Por el
contrario, cerca del 50% de los pacientes quirúrgicos en trata-
miento crónico con isoniazida mostraron un aumento significativo
de la concentración sérica de F
−50
En estudios con CYP2E1 humana
purificad
a 51se demostró que esta isoforma de CYP es la responsa-
ble fundamental, si no la única, de la desfluoración del enflurano
en el hígado humano. Parece que el tratamiento con isoniazida
aumenta significativamente el metabolismo del enflurano en seres
humano
s 51 .Isoflurano
El isoflurano (CHF
2
-O-CHCl-CF
3
), es un isómero del enflurano,
que se metaboliza incluso con más lentitud que el halotano y el
enflurano (
≈
0,2%) (v.
fig. 14-8 ). El metabolismo del isoflurano se
debe a la oxidación del carbono
a
por la CYP2E1 hepátic
a 52,53. El
intermediario hidroxilado inicial puede descomponerse y producir
un metabolito TFA-Cl idéntico al halotano o un éster trifluoroace-
til intermediario activo. Ambas sustancias pueden reaccionar con
agua para formar ácido trifluoroacético o con proteínas para
formar complejos de inclusión TFA-proteína. Durante estas reac-
ciones metabólicas se forman pequeñas cantidades de flúor
inorgánico.
Anestésicos inhalatorios: metabolismo y toxicidad
407
14
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
Figura 14-7
Principales metabolitos del metabolismo oxidativo y reductor
del halotano catalizado por CYP4502E1.









