
en el efecto de los fármacos. La farmacogenómica promete ser
una medicina personalizada: ofrece a los pacientes un fármaco
con un objetivo preciso a una dosis calibrada justa para tratar un
trastorno concreto. La farmacogenética empezó centrándose en
el metabolismo de los fármacos, pero se ha extendido a todo el
espectro de disposición de fármacos, que comprende la absor-
ción, el transporte, la excreción, los sitios de acción y la trans-
ducción de señales. Con la finalización del proyecto del genoma
humano, falta poco para conocer las secuencias de prácticamente
todos los genes que codifican enzimas catalizadoras de reacciones
de fase 1 y fase 2. En el análisis inicial del genoma humano se
identificaron más de 1,4 millones de polimorfismos de nucleóti-
dos únicos, con más de 60.000 de ellos localizados en la región
codificadora de genes. Algunos de estos polimorfismos de nucleó-
tidos únicos se han relacionado ya con cambios sustanciales en
el metabolismo o en el efecto de los tratamientos medicamento-
sos, y algunos se utilizan para predecir la respuesta clínica. La
farmacogenómica tiene el potencial de aportar herramientas de
diagnóstico molecular potentes para que los médicos puedan
seleccionar el fármaco y las dosis de forma individualizada. El
conocimiento de la farmacogenética ha llevado a poner en prác-
tica el análisis del genotipo de algunos fármacos con margen
terapéutico estrecho, como los derivados tiopurínicos azatioprina
y 6-mercaptopurina para el linfoma linfoblástico agud
o 22y el
irinotecán para el cáncer colorrecta
l 23 .Se ha estudiado el anticoa-
gulante warfarina, con un margen terapéutico estrecho y necesi-
dades de dosis con grandes variaciones individuales, y se ha
descubierto que las dosis medias de mantenimiento dependen del
genotipo CYP2C
9 24 .En estudios de investigación de los genes que
codifican CYP2C9 y vitamina K epóxido reductasa (VKORC1),
se ha demostrado que los pacientes con las variaciones de alelos
CYP2C9*2 y CYP2C9*3 y el haplotipo A/A de VKORC1 necesi-
tan dosis más bajas de warfarina para conseguir concentraciones
adecuadas con un riesgo de hemorragia mínim
o 25,26. En un
estudio más reciente se ha observado que la variabilidad inicial
del INR en los tratados con warfarina estaba asociada más a la
variabilidad genética del VKORC1 que de CYP2C
9 27. El genotipo
de CYP2C9 y el haplotipo de VKORC1 tuvieron una influencia
significativa en la dosis de warfarina necesaria después de 2 se
manas de tratamiento. En efecto, la dosis de mantenimiento de
warfarina en heterocigotos para CYP2C9*2/*3 es inferior a la
dosis en pacientes homocigotos para la enzima normal o hetero-
cigotos compuestos. El genotipo homocigoto CYP3C9*3 necesita
dosis incluso menores para lograr la cifra deseada de INR. En
verano de 2007, la Food and Drug Administration encontró los
datos acumulados relativos a la dosificación de warfarina sufi-
cientemente convincentes como para introducir un cambio en el
etiquetado de los envases de warfarina «para destacar la relevan-
cia potencial de la información genética en las decisiones a la
hora de prescribir». Los fármacos que inhiben la CYP2C9, como
la amiodarona y el fluconazol, cuando se toman con warfarina
aumentan su efecto anticoagulante y por tanto el riesgo de hemo-
rragia. Por el contrario, los fármacos que afectan al metabolismo
de la warfarina, como la cimetidina y el omeprazol, sólo produ-
cen un aumento discreto de la anticoagulación.
Metabolismo de los anestésicos
inhalatorios
Anestésicos inhalatorios no halogenados
Óxido nitroso
El óxido nitroso (N
2
O) es el único anestésico no halogenado que
continúa utilizándose en la clínica. No se metaboliza en los tejidos
humanos. Sin embargo, en ratas y en bacterias intestinales, cuando
el N
2
O reacciona con vitamina B
12
, se reduce a nitrógeno molecular
(N
2
). Esta reducción en bacterias puede producirse a través de un
proceso de transferencia de electrones, con formación de gas nitró-
geno (N
2
) y radicales libres. El N
2
O puede oxidar la vitamina B
12
e
inhibe su función de coenzima. Esto puede afectar a la actividad
de la metionina sintasa, que cataliza la transmetilación de metilte-
trahidrofolato y homocisteína para producir tetrahidrofolato y
metionina. La inhibición de la metionina sintasa puede disminuir
las concentraciones de tetrahidrofolato y metionina con el consi-
guiente deterioro de la síntesis de ADN y de las reacciones meta-
bólicas «carbono I», entre las que se encuentra la mutilación. Sin
embargo, este efecto en la actividad de la vitamina B
12
probable-
mente no tiene importancia durante la exposición de corta dura-
ción al N
2
O en la anestesia.
Xenón
En medicina se han descubierto distintas aplicaciones todavía en
expansión para los gases nobles inertes helio, neón, argón, criptón,
xenón y radó
n 28. El xenón, el criptón y el argón son química-
mente inertes en casi todas las circunstancias, y todos tienen
propiedades anestésicas. El xenón es especialmente interesante
porque es el único gas inerte anestésico en condiciones normo-
báricas. Se identificó por primera vez como anestésico en 195
1 29.
Aunque no está aprobada su utilización clínica, en Europa se ha
propuesto su regulación para uso médico. El xenón es un com-
ponente normal del aire atmosférico, a una concentración infe-
rior a 0,086 ppm y, por eso, a diferencia del resto de los anestésicos
inhalatorios, no es un contaminante ambiental. Este gas no se
puede fabricar, pero se obtiene en el proceso de destilación frac-
cionada del aire licuado, y después de varios pasos de separación,
puede obtenerse con una pureza superior al 99,99%. Actualmente
el coste del xenón es de cerca de 10 dólares (EE.UU.) por litro
(100 veces más caro que el óxido nitroso), y probablemente no
estará disponible para uso generalizado debido al gasto que
Anestésicos inhalatorios: metabolismo y toxicidad
405
14
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
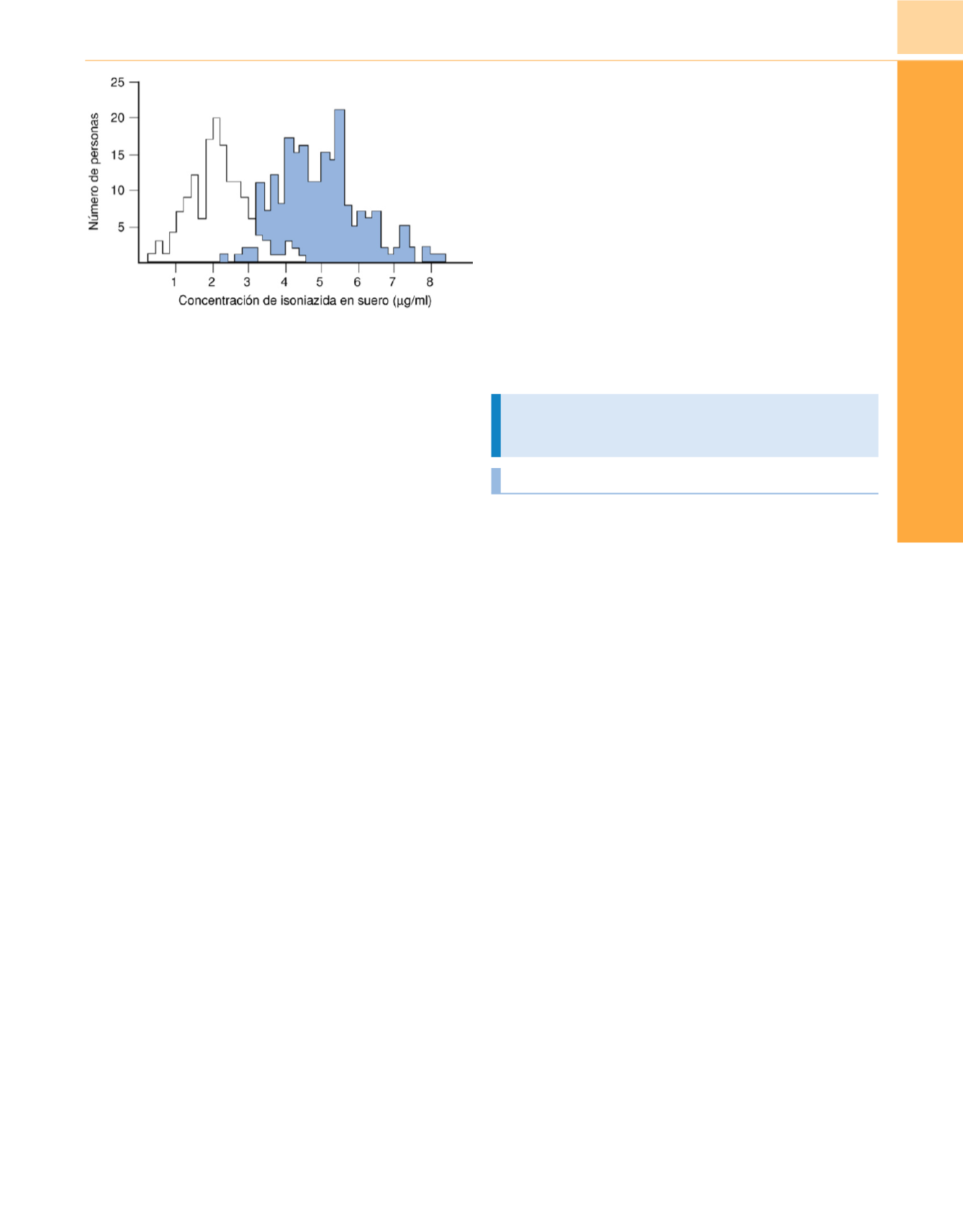
Figura 14-6
Distribución bimodal de las concentraciones séricas de
isoniazida en un amplio grupo de pacientes finlandeses. Se administraron
dosis de 5mg/kg de isoniazida i.v. a más de 300 pacientes. Se determinaron
las concentraciones séricas de fármaco en varios momentos después de
la inyección. Se muestra la distribución de las concentraciones de isoniazida
a los 180 minutos de la inyección. El histograma azul representa los
inactivadores rápidos y el histograma negro a los inactivadores lentos.
(De Petri WA Jr: Antimicrobial Mycobacterium complex disease and leprosy.
En Hardman JG, Limbird LE, Goodman GA [eds.]:
Goodman and Gillman’s
The Pharmacological Basis of Therapeutics,
10.
a
ed. Nueva York,
McGraw-Hill, 2001.)









