
La exposición total al sevoflurano fue de 201,3±98 minutos, con
una exposición media al compuesto A de 18,9±7,6ppm. La media
de exposición al isoflurano fue de 213,6±83,4 minutos, y se utilizó
Baralyme como absorbente de dióxido de carbono. No se encon-
traron cambios significativos en la urea y creatininas séricas, ni en
el aclaramiento de creatinina y las proteínas y la glucosa en orina
a las 24 y a las 72 horas después de la exposición a cualquiera de
los dos anestésicos.
¿Qué significa esto y como se traduce en la asistencia a los
pacientes? En un sistema cerrado con un absorbente cálcico de
dióxido de carbono (sosa cálcica o Baralyme), los pacientes
expuestos al sevoflurano inhalan compuesto A. Las concentracio-
nes típicas observadas en condiciones clínicas pueden variar y
dependen de varios factores, siendo el fundamental el flujo de gas
fresco inspirado. El factor clave para determinar el potencial
tóxico del sevoflurano es la exposición total más que la concen-
tración absoluta, expresando la exposición como el producto de
la concentración y el tiempo. De los múltiples estudios publicados
hasta el momento se deduce que el umbral mínimo para que el
sevoflurano y el compuesto A produzcan cambios renales es
150 ppm/horas. Con un flujo de gas fresco de 2 l/min, estas con-
centraciones sólo se alcanzan en condiciones de exposición pro-
longada al sevoflurano y no supone un problema para la gran
mayoría de los pacientes sometidos a cirugía y anestesia. En expo-
siciones prolongadas al sevoflurano, cuando se han observado
alteraciones renales, éstas han sido transitorias. Parece que el
compuesto A tiene interés académico y teórico, pero no hay datos
de que el sevoflurano produzca toxicidad renal clínica significa-
tiva. Se recomienda no administrar sevoflurano a los pacientes
con enfermedades renales, y que su administración siga las normas
del envase.
Halotano y bromoclorodifluoroetano
Los absorbentes del dióxido de carbono también degradan el
halotano mediante una reacción de deshidrofluoración y se
forma BCDFE (F
2
C=CBrCl). Eger y cols. compararon en un
estudio la posible nefrotoxicidad del BCDFE con la del com-
puesto
A 190 ,y observaron que: 1) el BCDFE era un 80% menos
reactivo que el compuesto A; 2) el halotano degradaba al BCDFE
de 20 a 40 veces menos que el sevoflurano al compuesto A en un
sistema circular estándar; 3) el BCDFE era un 75% menos nefro-
tóxico que el compuesto A en ratas, y 4) los compuestos que
bloqueaban la vía de la
b
-liasa renal no cambiaban o disminuían
la lesión renal por BCDFE, mientras que los mismos bloqueantes
o no cambiaban o aumentaban la lesión renal producida por
compuesto A
( fig. 14-21), lo que indica que el BCDFE y el com-
puesto A pueden producir lesión renal por mecanismos diferen-
tes. Estos estudios indican claramente que el riesgo de que el
BCDFE produzca nefrotoxicidad cuando se utiliza halotano es
mínimo.
Monóxido de carbono y calor
El monóxido de carbono (CO) es un gas incoloro e inodoro que es
tóxico porque desplaza el oxígeno de la hemoglobina en la sangre
produciendo carboxihemoglobina. Su afinidad por la hemoglobina
es 250 veces superior a la del oxígeno. Todas las personas tienen
algo de CO unido a la hemoglobina en la sangre, un 1% los no
fumadores y hasta un 10% los fumadores. Las concentraciones
altas de CO pueden producir problemas neuropsiquiátricos en los
pacientes, y cuando llegan al 50% pueden producir la muerte.
Durante la anestesia se han descrito casos de toxicidad por C
O 191-196 .Es difícil controlar la concentración de CO porque los pulsioxíme-
tros no distinguen entre carboxihemoglobina y oxihemoglobina.
Masimo acaba de desarrollar un pulsioxímetro que puede corregir
este problema.
Todos los anestésicos inhalatorios producen cierta canti-
dad de CO cuando reaccionan con las bases fuertes en los absor-
bentes de dióxido de carbono (CO
2
) relativamente secos (
<
5%
de agua
) 197 .En la producción de CO influyen varios factores
como la elección del anestésico, la concentración de anestésico
inspirado y el tipo, temperatura y, lo más importante de todo, el
grado de sequedad del absorbente de CO
2 198 .El desflurano es el
anestésico inhalatorio que produce más CO, seguido por el enflu-
rano, isoflurano y el halotano y sevoflurano con cantidades
mínimas
( fig. 14-22 ) 198,199. Se ha descrito formación intraopera-
toria de CO con el desflurano, el enflurano y el isoflurano, con
concentraciones de CO superiores a las establecidas como seguras
por la U.S. Environmental Protection Agency. El desflurano, el
enflurano y el isoflurano son éteres de difluorometil-etil, mien-
tras que el sevoflurano es un éter monofluorometil y el halotano
es un alcano. El mecanismo específico parece ser la abstracción
de un protón difluorometoxi desde el anestésico catalizada por
una base
( fig. 14-23 ) 199 .Además, se ha observado que la abstrac-
ción de un protón desde el grupo difluorometoxi es mayor con el
hidróxido de potasio (KOH) que con el de sodio (NaOH
) 199,200.
El hidróxido de bario (Ba[OH]
2
) contiene un 4,6% de KOH,
mientras que la sosa cálcica contiene sólo un 2,5% de KOH y un
1,5% de NaOH. A diferencia del KOH y el NaOH, el Ba(OH)
2
no
abstrae un protón del radical difluorometoxi y cataliza la forma-
ción de CO a partir de los anestésicos inhalatorios. Puesto que
las bases divalentes Ca(OH)
2
y Ba(OH)
2
son los principales com-
puestos activos de los absorbentes, la capacidad para producir
CO se agota rápidamente, mientras que los absorbentes mantie-
nen la capacidad de extraer CO
2
.
422
Farmacología y anestesia
II
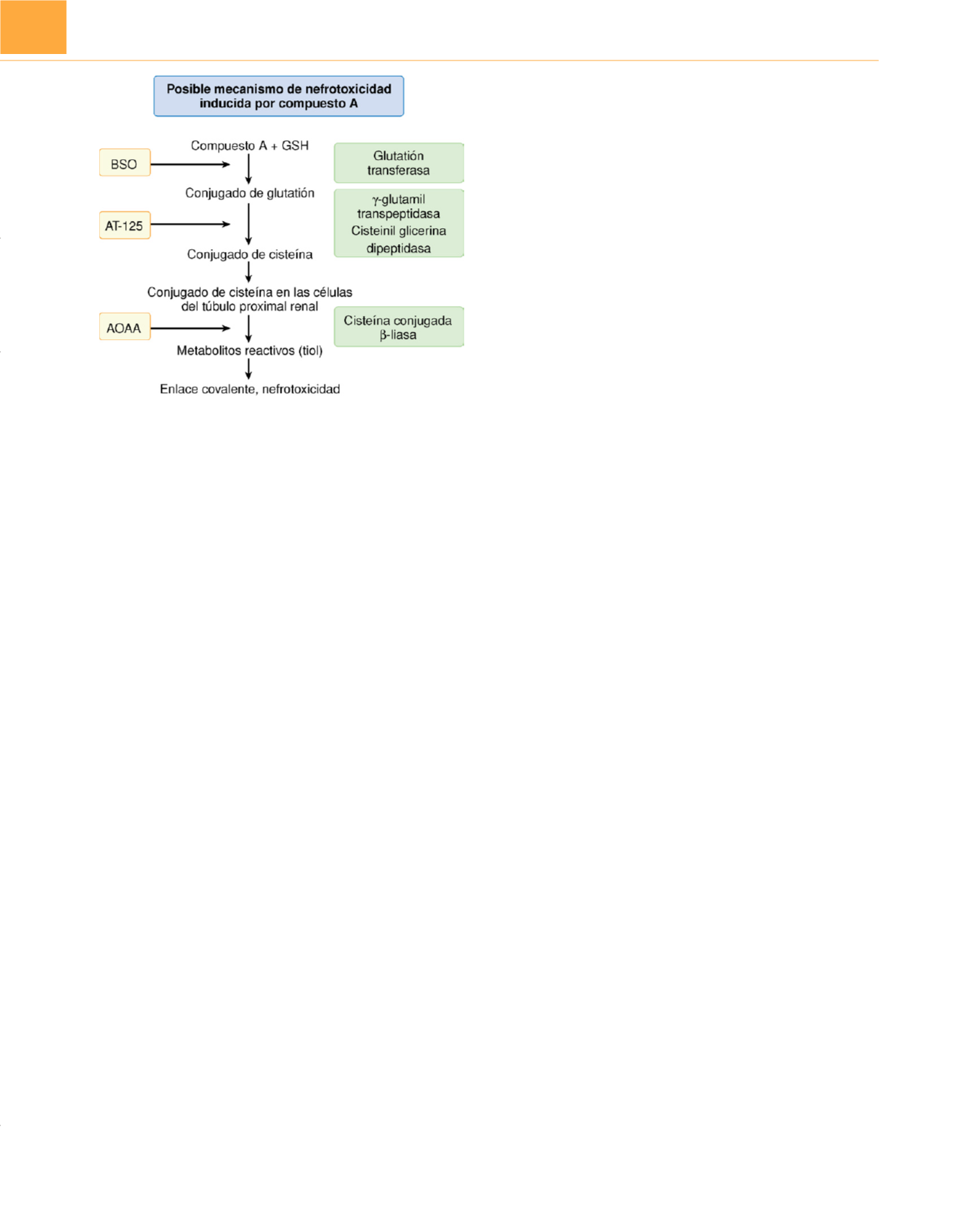
Figura 14-21
Pasos esenciales en la vía de la
b
-liasa: primero, conjugación
del compuesto A con glutatión en el hígado mediada por glutatión-
S
-
transferasa; este conjugado es transportado al riñón. Segundo, el
conjugado glutatión-
S
-transferasa se convierte en cisteína-
S
-conjugado,
proceso mediado por la
g
-glutamil transpeptidasa. El conjugado cisteína-
S
de compuesto A se convierte en tiol reactivo, reacción mediada por la
cisteína conjugada
b
-liasa renal; La
dl
-butionina-
(S,R)
-sulfoximina (BSO)
agota los depósitos endógenos de glutatión en el organismo, la acivina
(AT-125) inhibe la actividad de la
g
-glutamil transpeptidasa, y el ácido
monooxiacético (AOAA) inhibe la actividad de la
b
-liasa. El compuesto A,
sus conjugados y el tiol reactivo pueden producir necrosis renal, que es
posible en ratas después de la administración de compuesto A, y tanto en
ratas como en seres humanos la administración de este compuesto puede
producir glucosuria y enzimuria.









