
Los nuevos absorbentes de CO
2
a base de hidróxido de
calcio, como el Amsorb y el DragerSorb Free no contienen NaOH
ni KOH, son químicamente inertes y no degradan los anestésicos
inhalatorios a CO ni el sevoflurano a compuesto
A 201 .Los absor-
bentes completamente hidratados o los rehidratados no degradan
los anestésicos inhalatorios a CO. La sosa cálcica contiene un 15%
de agua y sólo cuando disminuye este grado de hidratación hasta
cerca del 1,4% se forman cantidades apreciables de CO. Por el
contrario, el Baralyme contiene un 13% de agua, y el umbral de
hidratación antes de que se forme CO es el 4,8%. Sin embargo,
incluso con este umbral se produce muy poco CO. Para que se
produzcan grandes cantidades de CO el absorbente debe estar seco
o casi seco, para lo que necesita flujos altos de gas seco (10 l)
durante períodos prolongados (1 a 2 días). Algunos pacientes
tenían niveles altos de CO, uno de ellos los lunes en concret
o 191 .Parece que esto se relaciona con la práctica de limpiar el aparato
de anestesia con gas fresco a flujos altos durante el fin de semana,
lo que seca el absorbente de CO
2
. Las temperaturas altas también
se relacionan con el aumento de producción de CO.
En general, la toxicidad por CO tiene poca relevancia clínica,
con independencia del anestésico utilizado, siempre que se sigan
unas normas simples para reducir al mínimo o eliminar el CO,
como la utilización de absorbente fresco, el uso de sosa cálcica en
vez de Baralyme y, mejor todavía, de los absorbentes de CO
2
a base
de calcio. También es útil evitar las técnicas que deshidratan el
absorbente de CO
2
en el circuito anestésico, como el flujo bajo de
gas fresco, que es más barato y limita la desecación del absorbente.
Como último recurso, se puede rehidratar simplemente añadiendo
un vaso de agua (230ml) por 1,2 kg de absorbente (bombona
estándar).
La interacción de los anestésicos inhalatorios con los
absorbentes de CO
2
es una reacción exotérmica que produce
calor. La temperatura de las bombonas de CO
2
durante la utili-
zación clínica varía entre los 25 y los 45 °C pero aumenta al dis-
minuir el flujo de gas fresco; el sevoflurano se asocia a una mayor
producción de calor. Esta reacción produce HFIP, formaldehído,
metanol, formato de sodio y, lo más importante, hidrógeno. La
elevada producción de hidrógeno, hasta 3 moles por mol de sevo-
flurano, facilita la ignición, y la baja solubilidad en los tejidos
aumenta el riesgo de incendios en los aparatos de anestesia por
reacciones con absorbentes de CO
2
desecados y sevofluran
o 202 .Estas reacciones pueden ser significativas y producir incendios,
gases tóxicos y lesiones a los paciente
s 203,204. En el laboratorio, la
exposición prolongada de 1 CAM de sevoflurano a absorbentes
de CO
2
desecados, produjo temperaturas de la bombona superio-
res a 300 °
C 205 .A estas temperaturas tan altas, las lesiones de los
pacientes como consecuencia de explosiones, incendios y el con-
tacto con los componentes plásticos del equipo de anestesia que-
mados y derretidos, son posibilidades reales. En dos estudios
recientes se notificaron concentraciones inferiores de productos
de degradación del sevoflurano con la utilización de absorbentes
de CO
2
de última generació
n 206,207. Es posible que pronto se sus-
tituyan los absorbentes de CO
2
a base de hidróxido de sodio y de
Anestésicos inhalatorios: metabolismo y toxicidad
423
14
Sección II
Farmacología y anestesia
© ELSEVIER. Fotocopiar sin autorización es un delito
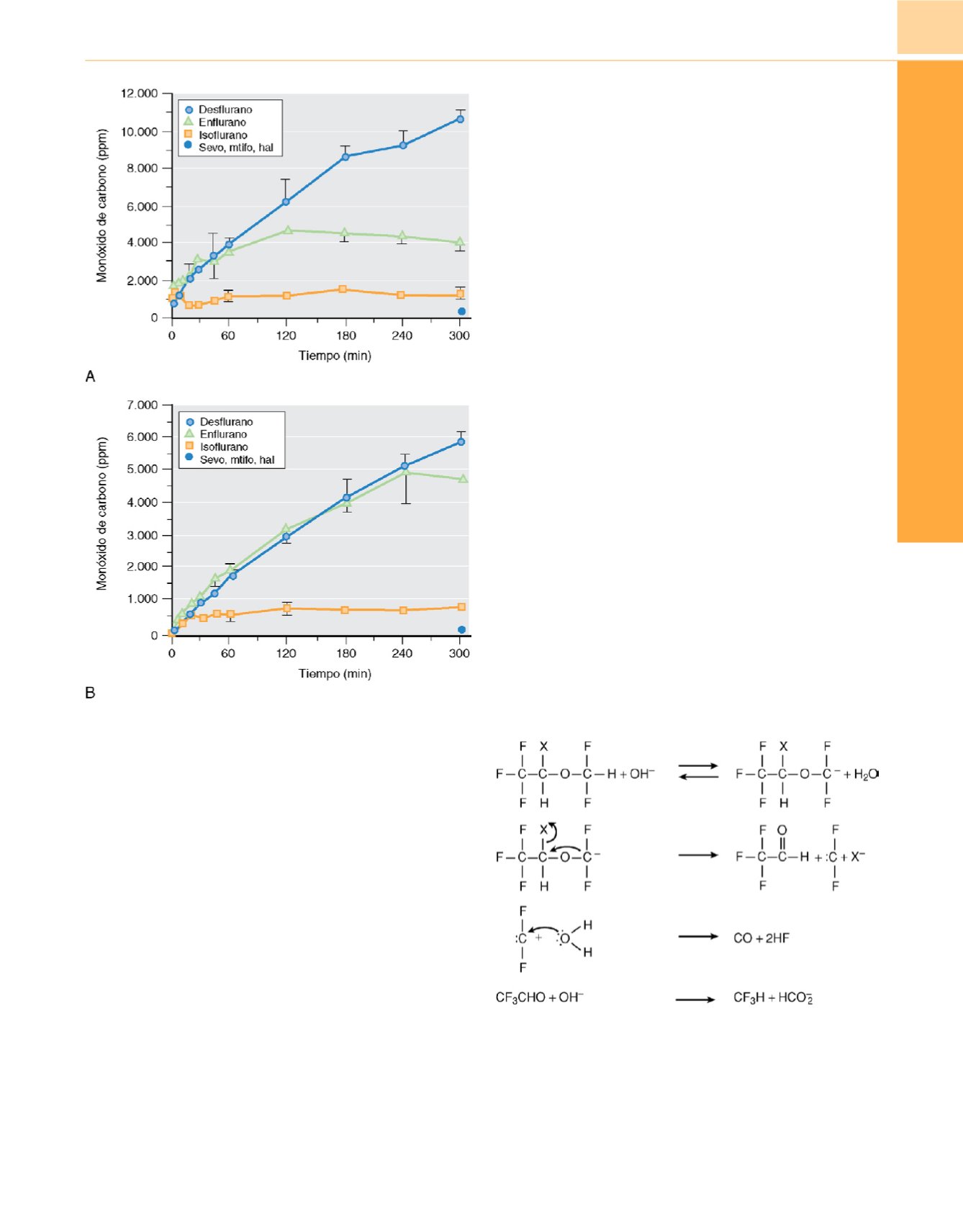
Figura 14-22
Degradación anestésica del monóxido de carbono a
concentraciones alveolares mínimas (1,5 CAM) por hidróxido de barrio
cálcio
(A)
y sosa cálcica
(B).
Los puntos son la media ± DE (
n
= 3). Los
puntos a los 300 minutos reflejan el monóxido de carbono indetectable
procedente del sevoflurano (sevo), metoxiflurano (mtifo) y halotano (hal).
(Adaptada de Baxter PJ, Garton K, Kharasch ED: Mechanistic aspects of
carbon monoxide formation from volatile anesthetics.
Anesthesiology
89:929-941, 1998.)
Figura 14-23
Mecanismo propuesto de formación de monóxido de carbono
a partir de anestésicos difluorometil-etil éter. Se muestra la estructura del
isoflurano (X=Cl) y del desflurano (X=F), junto con el supuesto mecanismo de
formación concomitante de trifluorometano. El agua en la línea 3 también
puede reaccionar como OH
−
.
(Adaptada de Baxter PJ, Garton K, Kharasch ED:
Mechanistic aspects of carbon monoxide formation from volatile anesthetics.
Anesthesiology
89:929-941, 1998.)









