
implicado en incendios del sistema respirador cuando se utiliza
sevoflurano. El hidróxido de calcio es uno de los absorbentes más
recientes. Está formado sobre todo por hidróxido de calcio y
cloruro de calcio, y contiene dos agentes fijadores: sulfato de
calcio y polivinilpirrolidina. Este último aumenta la dureza y
porosidad del absorbent
e 109 .La principal ventaja del hidróxido de
calcio es que carece de hidróxido de sodio y de potasio (bases
fuertes). La ausencia de estas sustancias elimina la producción no
deseada de CO y de compuesto A, sustancia nefrotóxica, y puede
disminuir o eliminar el riesgo de incendio en el circuito del res-
pirado
r 110 .Los inconvenientes más importantes del hidróxido de
calcio son su menor capacidad de absorción (cerca de un 50%
menos que los absorbentes con bases fuertes), y generalmente su
mayor coste por unida
d 111,112.
El tamaño de los gránulos de absorbente se ha determinado
por ensayo y error. Es una solución intermedia entre la resistencia
al flujo de aire y el rendimiento absortiv
o 113 .Con gránulos más
pequeños se consigue mayor superficie de absorción, pero aumenta
la resistencia al flujo de aire. Los gránulos de cal sodada y de
Baralyme utilizados en anestesia miden entre 4 y 8 mesh, tamaño
que optimiza la superficie absortiva y la resistencia al flujo. La
unidad mesh hace referencia al número de orificios por pulgada
lineal del tamiz a través del que pasan los gránulos. Una trama de
4 mesh indica que hay cuatro orificios de un cuarto de pulgada por
cada pulgada lineal, y una trama de 8 mesh tiene ocho orificios por
pulgada linea
l 107 .La absorción de dióxido de carbono por absorbentes
como la cal sodada es una reacción química, no un proceso
físico como la absorción de agua por una esponja. El dióxido de
carbono se une al agua y forma ácido carbónico. Éste reacciona
con los hidróxidos y forma carbonato de sodio (o de potasio) y
agua. El hidróxido de calcio acepta el carbonato para formar
carbonato de calcio e hidróxido de sodio o de potasio. Las ecua-
ciones son:
1. CO
2
+H
2
O
⇌
H
2
CO
3
2. H
2
CO
3
+2NaOH(KOH)
⇌
Na
2
CO
3
(K
2
CO
3
) +2H
2
O+Calor
3. Na
2
CO
3
(K
2
CO
3
) +Ca(OH)
2
⇌
CaCO
3
+2NaOH(KOH)
Parte del dióxido de carbono puede reaccionar directamente con
el Ca(OH)
2
, pero esta reacción es mucho más lenta.
Capacidad de absorción
La cantidad máxima de dióxido de carbono que puede absorber
la cal sodada es 26 l de CO
2
por 100 g de absorbente. La capaci-
dad de absorción del hidróxido de calcio es bastante menor,
unos 10,2 l por 100 g de absorbent
e 109,112 .Sin embargo, la capa-
cidad de absorción es el producto de la reactividad química y la
disponibilidad biológica (gránulos). Cuando los gránulos absor-
bentes se apilan en los recipientes se forman conductos entre
ellos. Estos pequeños conductos llevan los gases a las áreas de
baja resistencia. Debido a este fenómeno, la capacidad de absor-
ción de la cal sodada y del hidróxido de calcio puede disminuir
significativamente. En la práctica, el rendimiento de la cal sodada
puede disminuir hasta sólo 10-20 l o menos de dióxido de
carbono por 100 g de absorbente como consecuencia de esta
circulación
114 .Indicadores
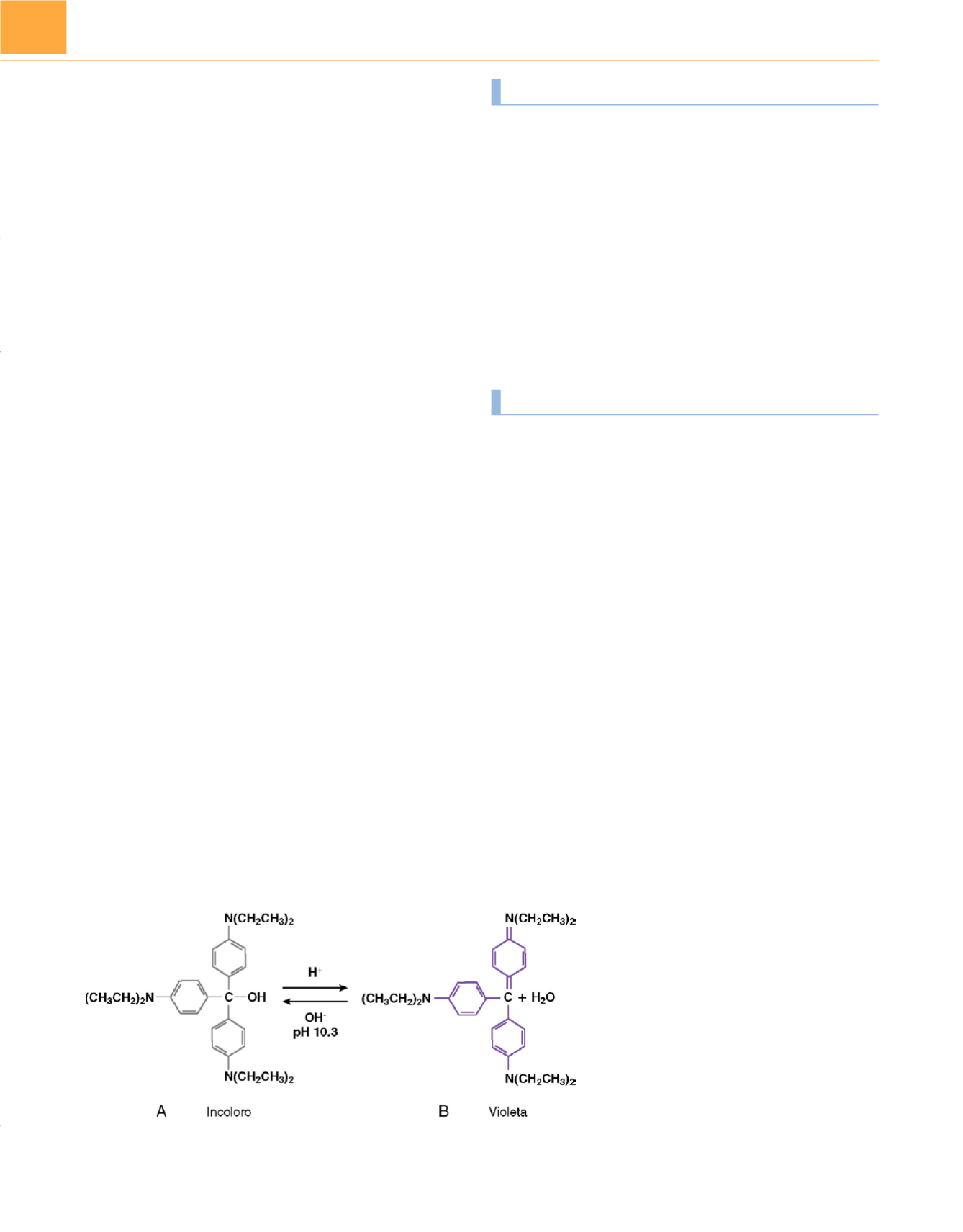
El violeta de etilo es un indicador de pH que se añade a la cal
sodada y al hidróxido de calcio para valorar la integridad funcio-
nal del absorbente. Es un colorante trifenilmetano sustituido con
un pH crítico de 10,
3 108 .El violeta de etilo cambia de incoloro a
violeta cuando el pH del absorbente disminuye por la absorción
de dióxido de carbono. Cuando el absorbente es fresco, el pH
sobrepasa el pH crítico del indicador, por lo que es incoloro
( fig. 15-26A ). Sin embargo, al agotarse el absorbente, el pH baja de 10,3,
y el violeta de etilo cambia a violeta por deshidratación alcohólica
( fig. 15-26B ). El cambio de color indica que la capacidad absortiva
del material se ha consumido. Por desgracia, en algunas circuns-
tancias el violeta de etilo no es un indicador fiable del estado
funcional del absorbente. La exposición prolongada del colorante
a la luz fluorescente puede producir una fotodesactivación y con-
tinúa blanco aunque el pH sea bajo por agotamiento de la capaci-
dad de absorció
n 115 .Algunos materiales de absorción nuevos incluyen indicado-
res que revelan si el material se ha desecado. Conviene consultar
las instrucciones del fabricante para comprobar si el material de
absorción utiliza este tipo de indicador.
462
Farmacología y anestesia
II
Figura 15-26
A
y
B
, Violeta de etilo. Véase texto para
los detalles.
(Reproducida con autorización de
Andrews JJ, Johnston RV Jr, Bee DE, Arens JF:
Photodeactivation of ethyl violet: A potential hazard of
Sodasorb. Anesthesiology 72:59, 1990.)









