
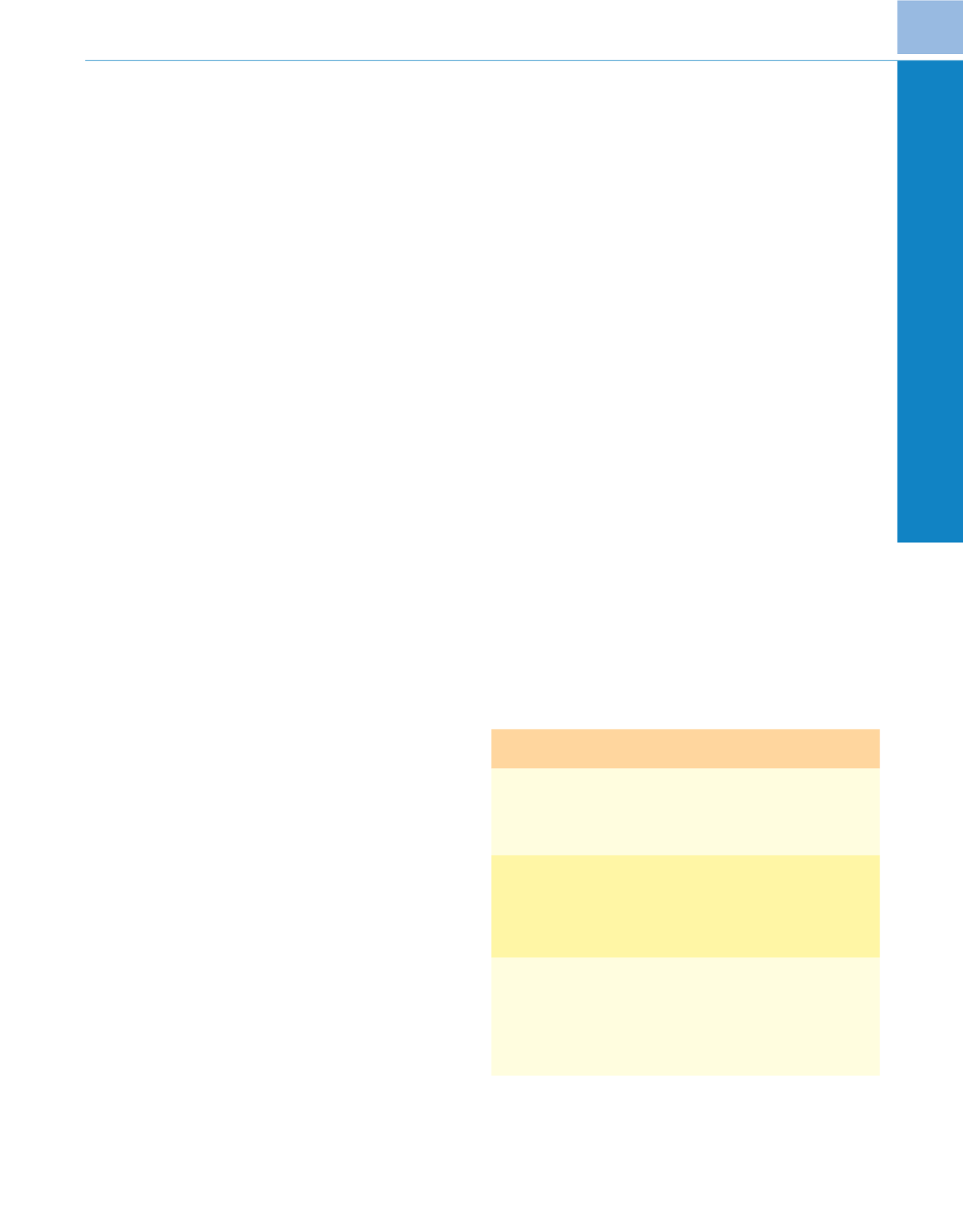
un ensayo aleatorizado más amplio sobre PCHP, asociada o no a la
perfusión regional cerebral a 20ml/kg/min, en pacientes con un
ventrículo único funcional, con estudios a largo plazo que se encuen-
tran en las fases de planificació
n 132. Se incluyeron 77 pacientes con
supervivencias parecidas hasta el alta hospitalaria (88%) y al año de
seguimiento (75%). No se encontraron diferencias significativas en
el índice de desarrollo psicomotor o mental entre los dos grupos
en ningún momento, aunque los valores de estos índices tendían a
ser más bajos en el grupo de perfusión cerebral regional.
Regulación de la glucosa
Una gran cantidad de datos experimentales y clínicos han aportado
pruebas concluyentes sobre los efectos negativos de la hipergluce-
mia durante la isquemia cerebral completa, incompleta y foca
l 133,134 .El papel de la glucosa como potenciador de las lesiones cerebrales
parece depender de dos factores: utilización de adenosina trifosfato
(ATP) y acidosis láctic
a 135,136. El metabolismo anaerobio de la glucosa
necesita de fosforilación y del consumo de dos moléculas de
ATP antes de que se pueda producir el ATP. Este gasto inicial
de ATP puede causar un agotamiento rápido del ATP y explicar por
qué la hiperglucemia empeora las lesiones neurológicas. La acidosis
láctica también es importante en las lesiones cerebrales agravadas
por la glucosa. Sin embargo, su relevante papel puede ser el de inhi-
bidor de enzimas glucolíticas. El lactato retrasa la producción anae-
robia de ATP al inhibir la glucólisis inmediatamente después de que
se consuma el ATP en la fosforilación de la glucos
a 137.
Es posible establecer argumentos científicos sólidos sobre los
efectos perniciosos de la hiperglucemia durante la isquemia, pero
existen pocas pruebas que apoyen una relación entre el empeora-
miento del pronóstico neurológico y la hiperglucemia durante la CEC
o la PCHP en los niños. Aunque una revisión retrospectiva de 34 niños
sometidos a PCHP indicó un pronóstico neurológico peor en los
niños con hiperglucemia, los resultados obtenidos se publicaron como
una tendencia sin significación estadístic
a 138 .Una revisión de las lesio-
nes neurológicas adquiridas en pacientes sometidos a la fase I de la
intervención de Norwood por un síndrome de corazón izquierdo
hipoplásico sugirió que la hiperglucemia era un hallazgo significativo
asociado en pacientes con necrosis cerebral extensa o hemorragia
intraventricular. Un gran número de otros factores potencialmente
dañinos (p. ej., períodos de hipoxia, presión diastólica y sistólica bajas,
trombocitopenia) se asociaban estadísticamente a la patología neuro-
lógica observad
a 139 .Dado que la hiperglucemia se asocia a una res-
puesta de estrés generalizada, estos trabajos no permiten distinguir si
la glucosa contribuye de forma directa a las lesiones neurológicas o si
sirve sencillamente como marcador de una población de alto riesgo
que sufre lesiones neurológicas como consecuencia de otros factores.
La hipoglucemia es una preocupación frecuente en los recién
nacidos durante el período perioperatorio. La disminución de la
gluconeogénesis hepática junto con una reducción de las reservas
de glucógeno hacen que el neonato tenga un mayor riesgo de epi-
sodios de hipoglucemia. En los recién nacidos con una cardiopatía
congénita, la disminución de la perfusión sistémica (p. ej., coarta-
ción crítica, síndrome del corazón izquierdo hipoplásico, estenosis
aórtica crítica) puede empeorar la biosíntesis hepática, deteriorando
aún más la producción de glucosa. Estos pacientes pueden depender
por completo de la glucosa exógena; por tanto, no es raro que nece-
siten infusiones de dextrosa al 20-30% para mantener la euglucemia
en el período previo a la CEC. Los niños mayores no son inmunes
tampoco a los episodios de hipoglucemia, por lo que pueden sufrir
lesiones neurológicas inducidas por ella. Los pacientes con situacio-
nes de bajo gasto cardíaco (miocardiopatías, pacientes antes del
trasplante, pacientes en estado crítico en el postoperatorio) que
necesitan una reintervención o que reciben un importante soporte
inotrópico presentan un riesgo mayor de que disminuyan sus reser-
vas de glucógeno y de sufrir hipoglucemia intraoperatori
a 140.
El impacto de la hipoglucemia durante la CEC se complica
todavía más por las consecuencias de la hipotermia, el control del
CO
2
y otros factores que pueden modificar las respuestas cerebrales
vasculares normales durante la CEC. En un modelo de perros, la
hipoglucemia inducida con insulina hasta 30mg/dl no alteraba los
signos electroencefalográficos. Sin embargo, tras 10 minutos de
hipoglucemia hipocápnica, el EEG se volvía plan
o 141 .Cuando se
analizó el flujo regional de sangre en estos animales, el flujo san-
guíneo cortical y del hipocampo seguía siendo normal, mientras
que en otras regiones del cerebro disminuía. La pérdida de la acti-
vidad electroencefalográfica por la hipoglucemia aislada no suele
producirse cuando la glucemia es superior a 8mg/dl
142 .Durante la CEC en hipotermia profunda y la PCHP se
alteran el FSC y el metabolismo cerebral. Los efectos aditivos de la
hipoglucemia, aunque sean leves, pueden causar alteraciones de la
autorregulación cerebral y culminar en un incremento de las lesio-
nes corticale
s 139 .La práctica habitual de emplear la hiperventila-
ción para reducir las RVP en los recién nacidos y los lactantes
durante el destete de la CEC y el período inmediato tras la misma
puede agravar aún más la lesión secundaria a hipoglucemia. La
monitorización de la glucosa y el mantenimiento rígido de la
euglucemia son una parte esencial del control de la CEC en el
paciente con una cardiopatía congénita.
Efectos renales
Tras la CEC, los efectos combinados de la hipotermia, la perfusión
no pulsátil y la reducción de la presión arterial media provocan la
liberación de angiotensina, renina, catecolaminas y hormonas anti-
diurética
s 143-145 .Estas hormonas circulantes inducen vasoconstric-
ción renal y disminuyen el flujo sanguíneo renal. Sin embargo, a pesar
del impacto negativo de la CEC sobre la función renal, los estudios no
han conseguido vincular la perfusión de bajo flujo y baja presión
no pulsátil con la disfunción renal postoperatoria
( tabla 73-12 ) 143. Los
factores que mejor se correlacionan con la disfunción renal postope-
ratoria son la disfunción renal preoperatoria y las reducciones inten-
sas del gasto cardíaco tras la CEC. Entre los factores preoperatorios
Anestesia para la cirugía cardíaca pediátrica
2389
73
Sección V
Anestesia pediátrica
© ELSEVIER. Fotocopiar sin autorización es un delito
Tabla 73-12
Secuelas de la circulación extracorpórea pediátrica
Lesión de órgano
terminal
Etiología/signos
Lesión renal
Inmadurez de órganos, nefropatía preexistente
Bajo GC tras circulación extracorpórea, uso de la
PCHP
Disfunción renal caracterizada por reducción del
FG y NTA
Lesión pulmonar
Lesión endotelial, aumento de la fuga capilar,
activación del complemento y degranulación de
leucocitos
Disfunción pulmonar caracterizada por una menor
distensibilidad, reducción de la CRF y aumento del
gradiente A-a
Lesión cerebral tras
una PCHP
Pérdida de autorregulación, supresión del
metabolismo y del flujo sanguíneo cerebral,
acidosis celular y vasoparesia cerebral
Disfunción del SNC caracterizada por convulsiones,
reducción del cociente de desarrollo,
coreoatetosis, discapacidad del aprendizaje,
alteraciones de la conducta
A-a, alvéolo-arterial; CRF, capacidad residual funcional; FG, filtrado glomerular; GC,
gasto cardíaco; NTA, necrosis tubular aguda; PCHP, parada circulatoria hipotérmica
profunda; SNC, sistema nervioso central.









